Op de loer in de modder en oppervlaktewater: Leptospira en Francisella tularensis

R. Pijnacker, R. Joosten, I. Janse, D. Brandwagt, E. Fanoy, S. van Dam, M. Petrignani, C. van der Weijden, F. Schets, J. van der Giessen, G. van Rijckevorsel, A. Tulen, J. van Pelt, L. Winkeler, A. Kraaijeveld, M. Goris, E. Franz
Het aantal buitensportevenementen waarbij de deelnemers in contact komen met oppervlaktewater of modder, zoals modderraces, obstakelraces, triatlons en city swims, is in Nederland in de afgelopen jaren flink toegenomen. Bij een modderrace of obstakelrace gaat de route vaak door de natuur en komen de deelnemers onderweg modder, water en hindernissen tegen. In 2012 waren er in Nederland 5 races; in 2015 werden er al meer dan 100 georganiseerd (www.obstakels.com). Dergelijke evenementen zijn echter niet geheel zonder risico. Naast de risico’s op verwondingen en blessures, zijn er ook risico’s op het oplopen van een infectieziekte. Er zijn uitbraken van onder andere norovirus- en campylobacterinfecties beschreven onder deelnemers van modderraces en triatlons. (1, 2) Daarnaast zijn meerdere uitbraken van leptospirose beschreven. (3-5) Ook tularemie kan zich voordoen bij mensen na contact met oppervlaktewater of modder. (6) In dit artikel worden de leptospirose- en tularemiepatiënten beschreven die in de afgelopen 10 jaar gerelateerd waren aan buitensportevenementen in oppervlaktewater en/of modder in Nederland. De rol van en het handelingsperspectief voor GGD’en wordt eveneens besproken.
Leptospirose
Leptospirose is een zoönose die wordt veroorzaakt door de bacterie Leptospira. In Nederland zijn de voornaamste reservoirs knaagdieren zoals de bruine rat, veldmuizen en muskusratten. (7, 8) Leptospiren leven in de nieren van hun natuurlijke gastheren en worden met de urine uitgescheiden. Buiten de gastheer kunnen ze geruime tijd overleven, vooral in een warme en vochtige omgeving. Besmettingen van de mens treden op via wondjes of slijmvliezen na direct contact met besmette dieren of indirect via de met urine gecontamineerde omgeving. In Nederland vindt besmetting meestal plaats via watercontact en in mindere mate door contact met aarde/modder of besmette dieren. (9) De ernst van de ziekte kan variëren van subklinische of griepachtige verschijnselen tot levensbedreigende complicaties. Het merendeel van de infecties verloopt asymptomatisch of mild.
Tularemie
Tularemie is eveneens een zoönose en wordt veroorzaakt door de bacterie Francisella tularensis en behoort tot de groep van potentieel bioterroristische micro-organismen. F. tularensis is wereldwijd geïsoleerd uit een veelheid van organismen waaronder zoogdieren, vogels, vissen, reptielen, insecten (muggen, dazen), teken en vrij levende amoeben. (10) F. tularensis kan lang endemisch in gebieden aanwezig zijn zonder tot uitbraken van ziekte bij mens of dier te leiden, mogelijk omdat de bacterie in natuurlijke biotopen kan persisteren. Na decennialange afwezigheid in Nederland wordt tularemie door subspecies holarctica vanaf 2011 af en toe aangetoond bij zowel mensen als hazen. Sinds 2011 worden er jaarlijks een aantal besmettingen met tularemie bij mensen in Nederland gemeld. (11) De meeste besmettingen worden opgelopen via wondjes die ontstaan tijdens het villen van een haas. (6) Andere mogelijke besmettingsroutes zijn steek of beet van een besmet insect of een besmette teek, contact met gecontamineerd water of gecontamineerde modder, consumptie van besmet (wild) vlees of inademing van aerosolen, zoals die bij maaiwerkzaamheden kunnen ontstaan. (12) De kans op de ziekte en de ernst ervan hangen af van de subspecies van F. tularensis die de infectie veroorzaakt, de dosis, de besmettingsroute en de immuunstatus van de patiënt. De ziekte kan asymptomatisch verlopen, maar ook algeheel orgaanfalen is beschreven. (12) In Europa is de ulceroglandulaire vorm (met plaatselijke zweren en lymfeklierzwelling) na infectie met subspecies F. tularensis subspecies holarctica verreweg de meest frequent voorkomende klinische uiting van tularemie.
Methode
Leptospirose en tularemie zijn beide meldingsplichtige infectieziekten uit groep C. Voor de meldingscriteria en meer informatie over diagnostiek verwijzen wij naar de (binnenkort herziene) richtlijnen van de Landelijke Coördinatie Infectieziektebestrijding (LCI). (8, 12) Volgens de Wet publieke gezondheid worden beide ziekten binnen 1 werkdag na diagnose door het laboratorium en de arts gemeld aan de GGD. Wanneer een leptospirose- of tularemiepatiënt wordt gemeld aan de GGD, neemt deze, na contact met de behandelaar, een vragenlijst af bij de patiënt over onder andere klinische verschijnselen, meest waarschijnlijke besmettingsbron en land waar de infectie waarschijnlijk is opgelopen. Aan de hand van de uitkomsten schakelt de GGD andere instanties in voor verder brononderzoek zoals het Dutch Wildlife Health Centre (DWHC), de Nederlandse Voedsel- en Warenautoriteit (NVWA), provincie/waterkwaliteitsbeheer of het RIVM. Ook schat de GGD besmettingsrisico’s voor derden in en adviseert welke aanvullende maatregelen noodzakelijk zijn. (13)
Voor dit overzichtsartikel hebben de auteurs gegevens van de landelijke surveillance van meldingsplichtige ziekten van het Centrum Infectieziektebestrijding (CIb) van het RIVM vanaf 2008 geraadpleegd. Tularemie is in november 2016 een meldingsplichtige infectieziekte geworden. In dit artikel worden ook de tularemiepatiënten beschreven die voor die tijd zijn gediagnosticeerd bij het RIVM of bij Wageningen Bioveterinary Research (WBVR).
Om inzicht te krijgen in de verspreiding van en mogelijke blootstelling aan F. tularensis werd de aanwezigheid van F. tularensis-DNA in diverse oppervlaktewateren verspreid over Nederland onderzocht met behulp van qPCR (polymerase chain reaction). (11) In de periode 2015-2017 zijn 339 monsters genomen op 127 willekeurig geselecteerde locaties waar waterschappen monsters verzamelen voor het monitoren van oppervlaktewaterkwaliteit. Daarnaast werd na 8 gemelde gevallen van tularemie bij mensen of hazen oppervlaktewater bemonsterd op meerdere plekken waar mogelijk de besmetting had plaatsgevonden. (14)
Resultaten
Leptospirose
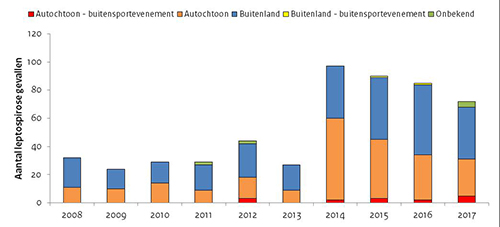
In de periode 2008 – 2017 werden 528 patiënten met leptospirose gemeld. Dit is een jaarlijks gemiddelde van 53 (spreiding: 24 – 97 patiënten) ( Figuur 1). Iets minder dan de helft (45%) van de patiënten had de ziekte opgelopen in Nederland. Opvallend was de toename van zowel het aantal autochtone als reisgerelateerde besmettingen sinds 2014. De toename van het aantal autochtone besmettingen was mogelijk het gevolg van milde winters en warme zomers, waardoor knaagdieren zoals ratten beter konden overleven, evenals de Leptospira-bacterie die met de urine werd uitgescheiden in het milieu. (15) Het warme weer heeft mogelijk ook geleid tot meer waterrecreatie en daarmee mogelijk tot toegenomen blootstelling aan de bacterie. Hoewel het aantal autochtone besmettingen jaarlijks afnam na 2014, was het aantal in 2017 nog steeds hoger dan voorheen.
Figuur 1. Aantal leptospirosepatiënten in Nederland naar land van besmetting, per jaar, 2008 – 2017
In totaal waren 15 patiënten (6% van de autochtone besmettingen) gerelateerd aan buitensportevenementen in oppervlaktewater en/of modder in Nederland: 12 aan modderraces of obstakelraces en 3 aan triatlons. Zwemevenementen zoals city swims werden niet geïdentificeerd als mogelijke bron van besmetting. Twee van de 15 patiënten waren gerelateerd aan dezelfde modderrace. Alle patiënten deden zich voor na 2011: 3 in 2012, 2 in 2014, 3 in 2015, 2 in 2016 en 5 in 2017. De eerste ziektedagen lagen in de periode augustus tot en met oktober, wat het gebruikelijke seizoen is voor leptospirose in Nederland. Het ging om 9 mannen en 6 vrouwen met een mediane leeftijd van 33 jaar (spreiding 17-59 jaar). De meldingen waren afkomstig van 9 verschillende GGD’en. Twaalf patiënten (80%) werden opgenomen in het ziekenhuis. Geen van de patiënten overleed als gevolg van de ziekte. Bij 6 patiënten was de infecterende serogroep bekend: Grippotyphosa (4x) en Icterohaemorrhagiae (2x). In Nederland zijn muskusratten en muizen de dragers van serogroep Grippotyphosa en ratten van serogroep Icterohaemorrhagiae.
Twee patiënten (<1% van de reisgerelateerde besmettingen) waren gerelateerd aan buitensportevenementen in oppervlaktewater en/of modder in het buitenland: een 26-jarige man die had meegedaan aan een obstakelrace in 2015 in België en een 67-jarige man die had meegedaan aan een cross country in 2016 in Engeland.
Tularemie
In de periode 2008-2017 werden 17 patiënten met tularemie geregistreerd. De eerste melding kwam in oktober 2011 en sindsdien zijn nog 16 patiënten met tularemie gemeld. De mediane leeftijd was 50 jaar (spreiding: 10-78 jaar) en het betrof alleen mannen. Met uitzondering van 2 patiënten die door dezelfde dode haas waren besmet waren de andere patiënten verspreid over het land. Alle patiënten hadden de infectie opgelopen in Nederland. Slechts 1 van de besmettingen was gerelateerd aan een modderrace. Het betrof een 10-jarige jongen die in september 2016 had meegedaan aan een modderrace georganiseerd voor kinderen en een week later lichamelijke klachten kreeg. Hij werd niet opgenomen in het ziekenhuis. Het water waar de modderrace was gehouden bevatte genetisch materiaal van F. tularensis. (14) Het aantonen van F. tularensis in de omgeving is echter nog niet te vertalen naar infectierisico en is daarmee niet bevestigend voor de bron. Een 50-jarige tularemiepatiënt, die ook in september 2016 gemeld werd, had de infectie waarschijnlijk ook opgelopen via modder. Dit was echter niet bij een buitensportevenement. De man had airsoft (een soort paintball) gespeeld en was daarbij door de modder gekropen.
Francisella tularensis in oppervlaktewater
Onderzoek liet zien dat F. tularensis sporadisch aangetoond kon worden in verschillende typen oppervlaktewater door heel Nederland, inclusief in zout water. 22 van de 127 monsters (17%) testten positief op F. tularensis subspecies holarctica op 1 of meerdere meetdagen. Positieve monsters waren verspreid over heel Nederland. Vaak ging het om een nét meetbare hoeveelheid, maar op 2 locaties werd een grote hoeveelheid bacteriën aangetoond.
In totaal werd 8 keer bemonstering van oppervlaktewater uitgevoerd naar aanleiding van een tularemiepatiënt of een dode haas. In 7 gevallen werd F. tularensis in 1 of enkele monsters gedetecteerd. Daarbij moet worden vermeld dat de bemonstering altijd pas ruime tijd (> 4 weken) na de mogelijke besmetting kon worden verricht. Dit komt omdat het enige weken duurde voordat de patiënt ziek werd en tularemie werd herkend, de GGD de casus had onderzocht en het RIVM een monstername had kunnen uitvoeren. Bovendien was de exacte plek van besmetting onbekend. In een aantal watermonsters werd bevestigd dat de aanwezige bacteriën subclades waren van het subtype F. tularenis holarctica. Hiervoor werd een nieuw sequencingprotocol ontwikkeld dat gebruikt kan worden om de aanwezigheid van specifieke genotypes te bepalen in watermonsters waar weinig materiaal in zit. Zo moet het mogelijk worden om een verdachte infectiebron in oppervlaktewater te koppelen aan een patiënt. (14).
Rol/handelingsperspectief van GGD’en
Preventie
De gemeente wordt vooraf geïnformeerd over publieke evenementen omdat hiervoor een speciale vergunning nodig is. Het is gebruikelijk dat de gemeente deze evenementen voorlegt aan de Gemeentelijke Hulpverleningsorganisatie in de Regio (GHOR). Of de GGD ook wordt ingelicht door de gemeente kan per gemeente anders georganiseerd zijn, maar meestal gebeurt dit via de GHOR. De taak van de GGD is om te overleggen met de evenementorganisatie en om deelnemers te informeren over gezondheidsrisico’s (zie voorbeeld kadertekst). Een aantal GGD’en hebben een folder ontwikkeld met informatie voor deelnemers aan buitensportevenementen met oppervlaktewater en modder. Ook is er GGD- informatie speciaal voor organisatoren van evenementen, over mogelijke gezondheidsrisico’s van deelnemers. Indien er meerdere patiënten gelinkt zijn aan 1 water- of modderlocatie, kan de GGD adviseren om het evenement uit te stellen of niet door te laten gaan. Deze opties zullen in het herziene LCI-draaiboek (Landelijke Coördinatie Infectieziektebestrijding van het RIVM) Infectieziekten gerelateerd aan recreatie in oppervlaktewater, dat voor de zomer van 2018 moet verschijnen, verder uitgewerkt worden. Hierin staan expliciet de handelingsperspectieven en -adviezen voor GGD’en genoemd. Ook de LCHV-richtlijn (Landelijk Centrum Hygiëne en Veiligheid van het RIVM) Hygiënerichtlijn voor Evenementen biedt informatie rondom veiligheid van evenementen. De checklist die voor inspectie gebruikt kan worden kan ook in de voorbereiding van het evenement gebruikt worden. Gezondheidsadviezen aan deelnemers van modderraces zijn algemeen, zoals direct douchen of afspoelen met leidingwater en afdrogen na afloop, het vermijden van inslikken van water en/of modder en het waterdicht afplakken van wonden. Ook is het mogelijk om modderhindernissen te bouwen met ‘onbesmet’ gemaakte modder (www.obstakels.com). Het risico op infectieziekten kan tevens verminderd worden door het verwijderen van dode dieren langs de route en het doorspoelen van het water. Andere adviezen om ziekte te voorkomen, los van tularemie en leptospirose, zijn onder andere het halen van een tetanusvaccinatie vooraf en het controleren controle op teken na afloop van het evenement.
Voorbeeldadvies van GGD regio Utrecht dat een organisatie van de modderrace op haar website kan plaatsen:
Deelnemers aan een modderrace of obstacle runs hebben een verhoogd risico op het oplopen van een infectieziekte. Door het inslikken van water of het aanraken van modder kunnen ziekmakende virussen en bacteriën binnenkomen. Mensen met afweerstoornissen en zwangere vrouwen worden dan ook afgeraden om deel te nemen aan dit evenement. Het is belangrijk om in goede gezondheid aan de start te verschijnen. Ben je ziek op de dag van het evenement, doe dan niet mee. Als de ziekte besmettelijk is kunnen andere deelnemers ook ziek worden.Veiligheidstips (Ook figuur 2):
- Houd je mond dicht op het moment dat je in het water of in de modder springt.
- Spoel jezelf direct na afloop schoon en droog jezelf goed af.
Brononderzoek
Bij elke patiënt met leptospirose of tularemie wordt brononderzoek uitgevoerd. Als er 2 of meer besmettingen gemeld worden met mogelijk dezelfde besmettingsbron zoals een modderrace - hetgeen wijst op mogelijk herhaalde blootstelling - kan de GGD overwegen om water of modder onderzoeken.
De GGD kan na een melding van een patiënt overwegen water of modder te onderzoeken, als er risico is op herhaalde blootstelling. Zeker wanneer er 2 of meer patiënten gemeld worden met mogelijk dezelfde besmettingsbron, zoals deelname aan dezelfde modderrace. Zoals eerder beschreven is het aantonen van F. tularensis-DNA in water en modder mogelijk en sinds kort kan ook het DNA van pathogene Leptospira aangetoond worden. (16) Aangezien dit specifieke expertise vereist, en de consequenties van de uitslagen onduidelijk zijn, wordt overleg hierover met het RIVM geadviseerd. Bij het aantonen van F. tularensis of Leptospira in omgevingsmateriaal (water of modder) kan de GGD, eventueel in overleg met het RIVM, overwegen de organisatie te informeren over de risico’s voor deelnemers en adviseren over het informeren van deelnemers. Het is echter moeilijk om zowel een positieve als negatieve uitkomst te vertalen naar een infectierisico voor deelnemers. Hoewel het aantonen van DNA van dode of levende F. tularensis of Leptospira een indicator is voor een infectierisico, is het onbekend hoe groot dit risico is. Daarnaast zegt de uitkomst van onderzoek enige dagen voor het evenement maar in beperkte mate iets over de blootstelling van deelnemers tijdens het evenement, bijvoorbeeld door doorstroming van water. Het uitroeien van Leptospira of F. tularensis in de omgeving is dan ook geen optie.
De aanwezigheid van knaagdieren in de omgeving is een belangrijke indicator voor de aanwezigheid van leptospiren en levert meer zinvolle en bruikbare informatie op dan onderzoek van oppervlaktewater. Het niet kunnen aantonen van pathogene leptospiren in het water suggereert veiligheid, maar het is een vals gevoel van veiligheid. (17) Onderzoek van dieren in dit soort situaties wordt om dezelfde reden afgeraden. In het herziene LCI-draaiboek Infectieziekten gerelateerd aan recreatie in oppervlaktewater zal het handelingsperspectief voor GGD’en verder uitgewerkt worden.
Beschouwing
Sinds 2012 wordt jaarlijks een aantal leptospirosepatiënten gemeld dat deel heeft genomen aan buitensportevenementen met oppervlaktewater en/of modder. Dit kan zowel het gevolg zijn van een toegenomen infectiedruk in de omgeving als van het feit dat er steeds meer van dit soort evenementen worden georganiseerd. Het aantal leptospirosemeldingen met deze evenementen als bron van besmetting is waarschijnlijk een forse onderschatting van het werkelijke aantal, omdat de meeste infecties een mild verloop hebben en alleen de ernstigere infecties herkend worden. Dit reflecteert zich in de gemelde leptospirosepatiënten die meestal waren opgenomen in het ziekenhuis.
Figuur 2. GGD Drenthe: Tips voor deelnemers aan obstacle runs (klik op de afbeelding voor een vergroting)
Belangrijk om te melden is dat meer dan de helft van de patiënten met een in Nederland opgelopen leptospirose de infectie oploopt via oppervlaktewater. (3) Dit gebeurt echter tijdens het zwemmen of watersporten en niet tijdens buitensportevenementen zoals besproken in dit artikel. De grootte van het risico op leptospirose bij deelname aan buitensportevenementen met oppervlaktewater en/of modder is lastig in te schatten. Hoewel er in Nederland geen uitbraken zijn gerapporteerd gerelateerd aan dergelijke evenementen, zijn er wel clusters bekend van leptospirosepatiënten gerelateerd aan zwemmen in oppervlaktewater. In 2015 werd melding gedaan van een cluster van 4 patiënten met leptospirose na zwemmen in de recreatieplassen van Strandpark Slijk-Ewijk, een officiële zwemlocatie. (18) De recreatieplassen werden hierna tijdelijk gesloten om meer patiënten te voorkomen. In 2016 werd een cluster van 3 leptospirosepatiënten gemeld: allen waren lid van een zwemclub en hadden gezwommen in niet-officieel zwemwater. (18) Hierop werd een geplande zwemmarathon die in het mogelijk besmette water gehouden zou worden op initiatief van de zwemclub afgelast. In het buitenland zijn wel meerdere uitbraken van leptospirose na triatlons en modderraces beschreven (4, 5, 19). In 2014 meldde Engeland een uitbraak van 5 vermoedelijke leptospirosepatiënten (waarvan 1 bevestigd) na een triatlon met 167 deelnemers. (18) In 2015 was er in België een leptosirose-uitbraak met 4 patiënten na een obstakelrace met 2.500 deelnemers. Uitbraken in Nederland zijn daarom niet ondenkbaar.
Ook is in 2016 een tularemiepatiënt gemeld die gerelateerd was aan een modderrace. (20) Metingen lieten zien dat de F. tularenis sporadisch aangetoond kan worden in verschillende typen oppervlaktewater door heel Nederland, inclusief in zout water. Het is moeilijk om deze bevinding te vertalen naar een risico voor blootstelling bij de mens bij deelname aan buitensportevenementen. Het is bekend dat klinisch relevante stammen van de bacterie lange tijd (jaren) kunnen overleven in het milieu, ook als er geen opgemerkte ziektegevallen zijn. (21) Er zijn in het buitenland wel uitbraken beschreven na blootstelling tijdens vissen of andere vormen van recreatie in een waterrijke omgeving (mogelijk ook via dazen), maar niet na een buitensportevenement zoals modderraces.
De afgelopen jaren zijn onderzoeken opgestart naar de infectierisico’s van zwemmen in niet-officieel stadswater en modderraces. In het artikel Obstacle runs en infectieziekten: tips voor de GGD-praktijk elders in deze editie van het Infectieziektebulletin wordt de rol en het handelingsperspectief voor GGD’en bij modder- en obstakelraces verder besproken. In het artikel Zwemmen in de gracht: hoe groot zijn de infectierisico’s? ook in dit bulletin, worden de gezondheidsklachten onder deelnemers aan city swims beschreven. Momenteel loopt een landelijk project genaamd Risicofactoren op gezondheidsklachten na deelname aan een Modder of Obstakel Run dat inzicht moet bieden in het (infectie)risico van deelnemers aan watersporten. Resultaten worden medio 2018 verwacht en moet handvatten bieden voor de GGD om advies uit te brengen aan evenementenorganisatoren en aan deelnemers van deze evenementen.
Auteurs
R. Pijnacker1, R. Joosten1, I. Janse1, D. Brandwagt1,2, E. Fanoy1,2, S. van Dam3, M. Petrignani4, C. van der Weijden5, F. Schets1, J. van der Giessen1, G. van Rijckevorsel1, A. Tulen1, J. van Pelt6, L. Winkeler7, A. Kraaijeveld7, M. Goris8, E. Franz1
- Centrum Infectieziektebestrijding, Rijksinstituut voor Volksgezondheid en Milieu
- GGD regio Utrecht
- GGD Hart voor Brabant
- GGD Haaglanden
- GGD Flevoland
- GGD Drenthe
- GGD Noord- en Oost-Gelderland
- OIE en Nationaal Referentielaboratorium voor Leptospirosen, Academisch Medisch Centrum
Correspondentie
Literatuur
- Parkkali S, Joosten R, Fanoy E, Pijnacker R, J VANB, Brandwagt D, et al. Outbreak of diarrhoea among participants of a triathlon and a duathlon on 12 July 2015 in Utrecht, the Netherlands. Epidemiology and infection. 2017:1-9.
- Zeigler M, Claar C, Rice D, Davis J, Frazier T, Turner A, et al. Outbreak of campylobacteriosis associated with a long-distance obstacle adventure race--Nevada, October 2012. MMWR Morbidity and mortality weekly report. 2014;63(17):375-8.
- Uiterwijk M, Keur I, Friesema I, Valkenburgh S, Holtslag M, van Pelt W, et al. Staat van Zoönosen 2016. Bilthoven: RIVM; 2017.
- Brockmann S, Piechotowski I, Bock-Hensley O, Winter C, Oehme R, Zimmermann S, et al. Outbreak of leptospirosis among triathlon participants in Germany, 2006. BMC infectious diseases. 2010;10:91.
- Radl C, Muller M, Revilla-Fernandez S, Karner-Zuser S, de Martin A, Schauer U, et al. Outbreak of leptospirosis among triathlon participants in Langau, Austria, 2010. Wiener klinische Wochenschrift. 2011;123(23-24):751-5.
- M. Koene, J. Rijks, M. Maas, M. de Rosa, E. Broens, P. Vellema, et al. Tularemie in Nederland, terug van weggeweest? . Tijdschrift voor Diergeneeskunde. 2015;140(8):23-7.
- Levett PN. Leptospirosis. Clinical microbiology reviews. 2001;14(2):296-326.
- LCI-richtlijn Leptospirose. [Available from: https://lci.rivm.nl/richtlijnen/leptospirose.
- Pijnacker R, Goris MG, Te Wierik MJ, Broens EM, van der Giessen JW, de Rosa M, et al. Marked increase in leptospirosis infections in humans and dogs in the Netherlands, 2014. Eurosurveille. 2016;21(17).
- Hestvik G, Warns-Petit E, Smith LA, Fox NJ, Uhlhorn H, Artois M, et al. The status of tularemia in Europe in a one-health context: a review. Epidemiology and infection. 2015;143(10):2137-60.
- Janse I, Maas M, Rijks JM, Koene M, van der Plaats RQ, Engelsma M, et al. Environmental surveillance during an outbreak of tularaemia in hares, the Netherlands, 2015. Eurosurveillance. 2017;22(35).
- LCI-richtlijn Tularemie. [Available from: https://lci.rivm.nl/richtlijnen/tularemie.
- LCI draaiboek. Infectieziekten gerelateerd aan recreatie in oppervlaktewater. Bilthoven: RIVM; 2011.
- Janse I, Van der Plaats RQ, de Roda-Husman AM, van Passel MWJ. Environmental Surveillance of Francisella tularensis holarctica in the Netherlands. Accepted for publication in Frontiers in Cellular and Infection Microbiology. 2018.
- van Oldenborgh GJ, Haarsma R, de Vries H, Allen MR. Cold extremes in North America vs. mild weather in Europe: the winter 2013/2014 in the context of a warming world. Bulletin of the American Meteorological Society. 2014:141230104505002.
- Becker E, Ahmed A, Goris M, Ruiter H, Wullings B, Kardinaal E. New DNA tool for detecting Weil’s disease bacteria and their source in surface water. Watermatters Knowledge journal. 2017;2.
- Uiterwijk M, De Rosa M, Friesema I, Valkenburgh S, Roest H, Van Pelt W, et al. Staat van zoönosen 2015. Bilthoven: RIVM; 2016.
- RIVM. Signaleringsoverleg [Available from: https://signalen.rivm.nl/.
- Monahan AM, Miller IS, Nally JE. Leptospirosis: risks during recreational activities. Journal of applied microbiology. 2009;107(3):707-16.
- Zijlstra M, Hulsker CCC, Fanoy EB, Pijnacker R, Kraaijeveld A, Koene MGJ, et al. Een jongen met tularemie na een modderrace. Nederlands tijdschrift voor geneeskunde. 2017;160(0):D1180.
- Broman T, Thelaus J, Andersson AC, Backman S, Wikstrom P, Larsson E, et al. Molecular Detection of Persistent Francisella tularensis Subspecies holarctica in Natural Waters. International journal of microbiology. 2011; 2011.