Surveillance van Listeria in Nederland in 2017

De surveillance van listeriose in Nederland is gestart in 2005 met een laboratoriumsurveillance. Sinds december 2008 is de ziekte meldingsplichtig. In 2017 werden 115 patiënten met listeriose geregistreerd, waaronder 3 zwangere vrouwen (3%). Tien volwassenen zijn overleden (9%). De meerderheid van de listeriosepatiënten hadden ernstig onderliggend lijden en/of gebruikten immunosuppressiva en/of maagzuurremmers. Elf patiënten vormden samen met 1 patiënt uit 2016 en 1 uit 2018 een uitbraakcluster. Verdere analyse van de gerapporteerde voedselconsumptie in dit cluster leidde naar haring als meest waarschijnlijke bron. Naast het grotere cluster werden een aantal kleinere clusters (2-6 patiënten) op basis van whole-genome sequencing gezien. Geen van de patiëntclusters uit 2017 clusterde met voedselisolaten die gevonden en gesequenced waren door de Nederlandse Voedsel- en Wareautoriteit (NVWA).
Listeria monocytogenes is een bacterie die overal in het milieu voorkomt en daarbij ook onder ongunstige omstandigheden, zoals droogte en lage temperaturen, kan overleven en zelfs kan groeien. Infectie bij de mens gebeurt voornamelijk via voedsel dat besmet wordt vanuit de productieomgeving. Het aantal mensen dat (ernstig) ziek wordt van Listeria is niet heel groot, maar de ziektelast is hoog door de ernst van de ziekte. (1, 2) In Nederland bestaat er sinds 2005 een laboratoriumsurveillance voor L. monocytogenes en een meldingsplicht sinds 2008. Daarnaast worden door de Nederlandse Voedsel en Waren Autoriteit (NVWA) jaarlijks diverse soorten risicovolle voedingsmiddelen op L. monocytogenes onderzocht. In deze rapportage presenteren we de resultaten van 2017 van beide surveillances en vergelijken die met elkaar en ten opzichte van voorgaande jaren.
Methode
Volgens de Wet Publieke Gezondheid (Wpg) (2008) is listeriose meldingsplichtig wanneer L. monocytogenes is geïsoleerd uit feces, bloed of liquor of (in geval van een zwangerschap) uit materiaal van een foetus, doodgeboren kind, pasgeboren kind of de moeder. Medisch microbiologische laboratoria dienen elke positieve kweek van L. monocytogenes te melden aan de GGD. De GGD neemt vervolgens contact op met de patiënt of naasten van de patiënt en neemt een korte vragenlijst af over medische achtergrond, klinisch beloop en blootstelling aan mogelijke risicofactoren in de 30 dagen voor het begin van de klachten. Deze gegevens worden via de webapplicatie Osiris geregistreerd bij het RIVM.
Daarnaast wordt de laboratoria gevraagd Listeria-isolaten van patiënten met meningitis of sepsis naar het Nederlands Referentielaboratorium voor Bacteriële Meningitis (NRBM) te sturen waar de isolaten getypeerd worden met serotypering. Er zijn meer dan 14 verschillende serotypes bekend voor L. monocytogenes. Slechts 4 serotypes, namelijk 1/2a, 1/2b, 1/2c en 4b, zijn verantwoordelijk voor >95% van alle humane infecties.
Het NRBM stuurt vervolgens de stammen door naar het RIVM die de isolaten typeert met whole-genome sequencing (WGS). De WGS-data worden gebruikt voor clusterdetectie (2 of meer (vrijwel) identieke stammen uit verschillende bronnen/patiënten) met core-genome multi-locus sequence typing (cgMLST). Bij een cluster is er alleen sprake van (vrijwel) identieke stammen. Als er daarnaast aanwijzingen zijn dat er een epidemiologische link is tussen patiënten, al dan niet met een link naar een voedselproduct, wordt gesproken van een uitbraak. De cgMLST-clusterdetectie vervangt de PFGE-analyse die tot 2017 werd gedaan.
De NVWA onderzoekt jaarlijks diverse soorten risicovolle voedingsmiddelen op aanwezigheid van L. monocytogenes in het kader van haar toezichtstaak. Hieronder valt ook het brononderzoek naar aanleiding van meldingen van voedselinfecties. Het surveillanceonderzoek van L. monocytogenes door de NVWA richt zich vooral op kant-en-klare levensmiddelen. Volgens Verordening (EG) nr. 2073/2005 mogen er in kant-en-klare levensmiddelen die in de handel zijn gebracht niet meer dan 100 kolonievormende eenheden (kve) L. monocytogenes per gram voorkomen gedurende de houdbaarheidstermijn. Kant-en-klare zuigelingenvoeding en kant-en-klare voeding voor medisch gebruik, zoals drinkvoeding, mogen in het geheel geen L. monocytogenes bevatten (afwezigheid in 25 g). De door de NVWA onderzochte monsters zijn kwalitatief (detectie in 25 g) en/of kwantitatief (telling met detectielimiet 10 kve/g) onderzocht op aanwezigheid van L. monocytogenes (ISO 11290-1 en -2). Bij een geconstateerde afwijking van de norm zal de NVWA de verkoper en/of de producent op de hoogte brengen opdat deze een interventie kan plegen. Tevens voert de NVWA in het kader van haar bronopsporingstaak nader typeringsonderzoek uit op de door haar verkregen voedselisolaten. De door de NVWA verkregen voedselisolaten zijn getypeerd met behulp van moleculaire ‘serotypering’, op basis van WGS-data (genoserotypering). Het verschil tussen klassieke serotypering (door het NRBM) en genoserotypering (door de NVWA) is dat genoserotypering alleen discrimineert tussen 5 gedefinieerde genoserogroepen; IIa (=1/2a en 3a), IIb (=1/2b, 3b en 7), IIc (=1/2c en 3c), IVa (=4a en 4c) en IVb (=4b, 4d en 4e). (3, 4) Ondanks dit minder discriminerend vermogen van de genoserotypering geeft deze methode toch een voldoende karakterisering. Dit komt doordat de meest voorkomende serotypes 1/2a, 1/2b, 1/2c en 4b elk in een andere genoserogroep vallen en dus van elkaar te onderscheiden zijn.
Resultaten
Aantal gerapporteerde ziektegevallen en klinisch beeld
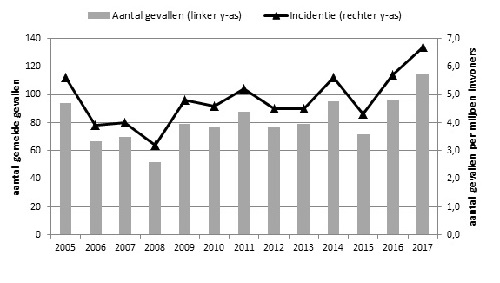
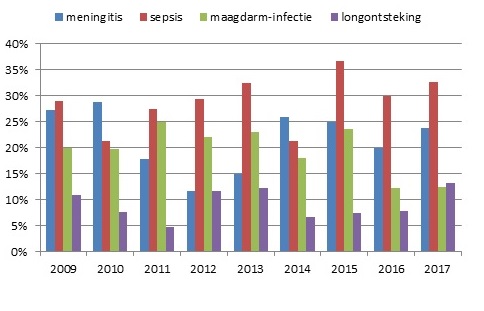
In 2017 werden 115 patiënten gerapporteerd met een infectie met L. monocytogenes. Dit komt overeen met een incidentie van 6,7 patiënten per miljoen inwoners (Figuur 1). Elf patiënten vormden samen met 1 patiënt uit 2016 en 1 uit 2018 het eerste landelijke uitbraakcluster sinds de start van de surveillance in 2005. Via Osiris werden 113 patiënten gemeld (van 101 werd ook een isolaat naar het NRBM en/of RIVM gestuurd) en van 2 patiënten was alleen een isolaat ingestuurd. De mediane leeftijd van alle patiënten was 74 jaar (range 19-94 jaar) en 60% van de patiënten was man. De meest voorkomende ziektebeelden waren sepsis, meningitis, longontsteking en maagdarminfectie (Figuur 2). Sepsis werd het meest gemeld (37 patiënten), gevolgd door meningitis (27 patiënten). De zeldzamere ziektebeelden encefalitis en endocarditis werden respectievelijk bij 4 en 3 patiënten gediagnosticeerd. Van 113 patiënten van wie het beloop van de infectie bekend was, zijn er 10 overleden (9%) met een mediane leeftijd van 81 jaar (range 70-93 jaar). Drie patiënten (3%) waren zwanger toen zij listeriose hadden, waarbij 2 kindjes doodgeboren werden, en 1 kindje voor zover bekend geen symptomen had.
Figuur 1. Aantal patiënten met een L. monocytogenes infectie met bijbehorende incidentie, 2005-2017
Figuur 2. Verdeling van 4 belangrijkste ziektebeelden van listeriose, 2009-2017
Gegevens over risicofactoren
Mensen met onderliggend lijden en/of medicijngebruik hebben een verhoogd risico op listeriose. Twee vrouwen en 5 mannen in de leeftijd 63-88 jaar hadden geen onderliggend lijden en gebruikten geen maagzuurremmers of immunosuppressiva. Maagzuurremmers werden door 57% van de listeriosepatiënten gebruikt en bijna de helft (46%) slikte immunosuppressiva (Tabel 1); een kwart van de patiënten slikte beide. De 3 meest genoemde onderliggende ziekten in 2017 waren kanker, hart- en vaatziekten en longziekten. Vooral het aantal patiënten met een longziekte (18%) valt daarbij op; in voorgaande jaren had maximaal 10% van de patiënten een longziekte. Patiënten met een longziekte werden daarbij 2 keer vaker met een listerioselongontsteking gemeld dan de overige patiënten. Hetzelfde werd ook gezien voor maagdarminfectie bij patiënten met een maagdarmaandoening. In tabel 2 staan de meest geconsumeerde risicoproducten. Twee producten vallen voornamelijk op: 60% van de patiënten heeft worst/worstjes gegeten, terwijl dit in de voorgaande jaren onder de helft (39-48%) bleef. Ook haring is in 2017 meer gegeten met 43% ten opzichte van 27-36% in voorgaande jaren. Binnen het landelijke cluster werd een sterke associatie met haring gezien (8/13; 62%), ten opzichte van 40% van de patiënten in 2017 buiten het cluster.
Tabel 1. Osirisgegevens over onderliggend lijden en medicijngebruik bij patiënten met een L. monocytogenesinfectie, 2013-2017
Onderliggende condities en medicijngebruik | 2017 n / N (%) | 2016 n / N (%) | 2015 n / N (%) | 2014 n / N (%) | 2013 n / N (%) |
Diabetes | 17 / 111 (15) | 18 / 88 (20) | 14 / 68 (21) | 13 / 88 (15) | 17 / 71 (24) |
Leverziekte | 9 / 111 (8) | 10 / 88 (11) | 3 / 68 (4) | 3 / 88 (3) | 4 / 71 (6) |
Nierziekte | 14 / 111 (13) | 11 / 88 (13) | 10 / 68 (15) | 11 / 88 (13) | 13 / 71 (18) |
Hart- en vaatziekten | 30 / 111 (27) | 21 / 88 (24) | 16 / 68 (24) | 17 / 88 (19) | 16 / 71 (23) |
Kanker | 39 / 111 (35) | 26 / 88 (30) | 20 / 68 (29) | 30 / 88 (34) | 20 / 71 (28) |
Immuunstoornis | 3 / 111 (3) | 7 / 88 (8) | 5 / 68 (7) | 11 / 88 (13) | 3 / 71 (4) |
Longziekte | 20 / 111 (18) | 4 / 88 (5) | 3 / 68 (4) | 9 / 88 (10) | 5 / 71 (7) |
Maagdarmziekte | 10 / 111 (9) | 5 / 88 (6) | 5 / 68 (7) | 7 / 88 (8) | 5 / 71 (7) |
Transplantatie-orgaan | 4 / 111 (4) | 3 / 88 (3) | 2 / 68 (3) | 4 / 88 (5) | 4 / 71 (6) |
Reuma | 7 / 111 (6) | 6 / 88 (7) | 6 / 68 (9) | 13 / 88 (15) | 6 / 71 (8) |
Alcoholmisbruik | 3 / 111 (3) | 7 / 88 (8) | 4 / 68 (6) | 3 / 88 (3) | 2 / 71 (3) |
Andere ziekte | 14 / 111 (13) | 10 / 88 (11) | 7 / 68 (10) | 7 / 88 (8) | 12 / 71 (17) |
Medicijngebruik: Immunosuppressiva Maagzuurremmers |
46 / 99 (46) 50 / 87 (57) |
39 / 82 (48) 42 / 71 (59) |
26 / 58 (45) 34 / 47 (72) |
50 / 84 (60) 38 / 67 (57) |
35 / 62 (56) 24 / 55 (44) |
Geen onderliggend condities | 7 / 111 (6) | 3 / 88 (3) | 4 / 67 (6) | 6 / 88 (7) | 1 / 72 (1) |
Tabel 2. Osirisgegevens over activiteiten en voedselconsumptie* in de 30 dagen vóór de klachten bij patiënten met een L. monocytogenesinfectie, 2013-2017
Risicofactoren | 2017 n / N (%) | 2016 n / N (%) | 2015 n / N (%) | 2014 n / N (%) | 2013 n / N (%) | |
Activiteiten | ||||||
Reis buitenland | 5 / 109 (5) | 1 / 85 (1) | 2 / 66 (3) | 3 / 85 (4) | 2 / 68 (3) | |
Voedselconsumptie | ||||||
Worst/worstjes | 54 / 90 (60) | 24 / 62 (39) | 19 / 41 (46) | 32 / 67 (48) | 20 / 48 (42) | |
Rosbief | 18 / 90 (20) | 22 / 62 (35) | 7 / 41 (17) | 13 / 67 (19) | 9 / 48 (19) | |
Rauwe ham | 19 / 90 (21) | 12 / 62 (19) | 8 / 41 (20) | 9 / 67 (13) | 7 / 48 (15) | |
Gekookte/gerookte ham | 38 / 90 (42) | 26 / 62 (42) | 19 / 41 (46) | 32 / 67 (48) | 20 / 48 (42) | |
Kip/kalkoen vleeswaren | 34 / 90 (38) | 23 / 62 (37) | 16 / 41 (39) | 31 / 67 (46) | 18 / 48 (38) | |
Gerookte zalm | 30 / 92 (33) | 23 / 62 (37) | 11 / 44 (25) | 12 / 69 (17) | 16 / 51 (31) | |
Gerookte makreel | 24 / 92 (26) | 12 / 62 (19) | 6 / 44 (14) | 13 / 69 (19) | 12 / 51 (24) | |
Haring | 40 / 92 (43) | 17 / 62 (27) | 16 / 44 (36) | 19 / 69 (28) | 16 / 51 (31) | |
Kibbeling/lekkerbek | 24 / 92 (26) | 16 / 62 (26) | 13 / 44 (30) | 17 / 69 (25) | 14 / 51 (28) | |
Totaal zachte kazen | 35 / 93 (38) | 34 / 63 (54) | 17 / 46 (37) | 31 / 72 (43) | 28 / 54 (52) | |
* Consumptie van voedsel alleen weergegeven indien door tenminste 20% van de patiënten in 2016 genoemd
Onderzoek levensmiddelen
In 2017 onderzocht de NVWA circa 4900 (partijen van) levensmiddelen op aanwezigheid (kwalitatief en/of kwantitatief) van L. monocytogenes. Hieruit zijn 227 isolaten verkregen. 95% van de isolaten is verkregen uit de kwalitatieve methode, waarbij het besmettingsniveau onder de 100 kve/gram ligt. De isolaten zijn verkregen uit: 38 visproducten (15 zalm, 12 haring), 55 vers pluimveevlees (47 kip, 8 kalkoen), 74 bereid pluimveevlees (71 kip, 3 kalkoen), 28 rundvlees, 15 vleesproducten rauw te consumeren (9 filet américain), 9 lamsvlees, 5 varkensvlees en elk 1 in partij tahin, tapas, en 1 maaltijdsalade.
Serotypering van patiënt- en voedselisolaten
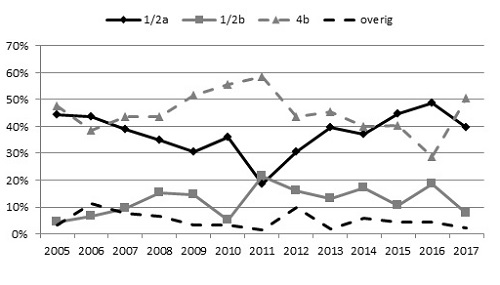
Van 102 patiënten was een isolaat beschikbaar voor serotypering en/of sequencing en van 1 patiënt ontvingen we de sequencegegevens van een regionaal laboratorium. De meeste isolaten waren afkomstig uit bloed (72%), liquor (9%) en bloed en liquor (11%). De 9 overige isolaten waren afkomstig uit ascites (2), pleuravocht (2), weefsel/vocht knie (2), galvocht (1), en overig niet gespecificeerd (2). Van 93 patiënten is het isolaat door het NRBM geserotypeerd. L. monocytogenes serotype 4b werd bij 51% van de patiënten geïsoleerd en is daarmee, evenals in de periode 2007-2014, het meest gevonden serotype, gevolgd door 1/2a (40%) en 1/2b (8%) (Figuur 3). Serotype 1/2c werd 1 keer aangetoond en ten slotte eenmaal 1/2.
Op basis van genoserotypering konden de isolaten uit voedsel worden ingedeeld in verschillende groepen. Van de isolaten waar een genoserotype van bepaald kon worden waren 129 stammen genoserogroep IIa (60%), 58 stammen genoserogroep IIc (27%), 11 stammen genoserogroep IIb (5%) en 16 stammen genoserogroep IVb (7%). Voor 13 isolaten kon het genoserotype niet bepaald worden. Alle geïdentificeerde genoserotypes kwamen in de verschillende geteste voedsel categorieën voor.
Figuur 3. Serotypering van de humane isolaten, 2005-2017
Clusteranalyse
In 2017 werden voor het eerst standaard WGS-data gebruikt voor clusterdetectie. Van de isolaten van 97 patiënten waren WGS-data beschikbaar. Voor het eerder genoemde cluster met 11 patiënten in 2017 en elk 1 patiënt in 2016 en 2018 lagen de eerste ziektedagen tussen 9 december 2016 en 7 januari 2018. De patiënten waren in de leeftijd 51-89 jaar (mediaan 78 jaar) en 62% was man. Analyse van de voedselconsumptie opgegeven in Osiris leidde naar haring (8/13; 62%) als meest waarschijnlijke bron. De NVWA heeft aan de hand van detailgegevens van de aankoopplekken van de haring een trace-back uitgevoerd, wat niet naar een gezamenlijke leverancier of locatie heeft geleid.
Er werden nog 11 andere, kleinere patiëntclusters geïdentificeerd met in totaal 30 patiënten (6 clusters van 2 patiënten, 4 clusters van 3 en een cluster van 6 patiënten). Echter, deze clusters waren dermate klein dat op basis van de beschikbare gegevens geen gezamenlijke bron aangewezen kan worden en verder onderzoek weinig zou toevoegen.
Geen van de in 2017 gevonden patiëntclusters clusterde op basis van WGS met voedselisolaten. Alleen 4 ongelinkte patiëntisolaten clusterden ieder met een voedselisolaat uit 2016 (1), 2017 (2) of 2018 (1). In 3 van de 4 clusters werd het voedselisolaat enkele maanden tot 1 jaar eerder gevonden dan de patiënt, in het vierde geval werd het voedselisolaat ongeveer 1 maand later gedetecteerd.
Discussie
Het tweede jaar op rij is het aantal listeriosemeldingen toegenomen en lag in 2017 voor het eerst boven de 100 met 115 patiënten (incidentie 6,7 patiënten per miljoen inwoners). Sinds de invoering van de meldingsplicht eind 2008 lag de incidentie van gerapporteerde listeriose tussen 4,3 en 5,7 patiënten per miljoen inwoners. In de Europese Unie (EU) lag de gemiddelde incidentie in 2017 op 4,8 patiënten per miljoen inwoners, met 8,0 en 8,8 patiënten per miljoen inwoners in respectievelijk België en Duitsland (3). Elf patiënten in 2017 waren gerelateerd aan de eerste landelijke uitbraak van listeriose in Nederland sinds de start van de surveillance in 2005. De bron van de uitbraak is niet gevonden. Er was een sterke epidemiologische associatie met haring. De grote spreiding van de patiënten over de tijd (14 maanden) bemoeilijkte het onderzoek. Daarnaast maakt de lange incubatietijd tot ongeveer 4 weken bij Listeria het voor de patiënten lastig om zich te herinneren wat ze precies hebben gegeten tijdens de voor de besmetting relevante periode.
Van 90% van de patiënten was een stam beschikbaar, terwijl dit in 2013-2016 tussen 65% en 74% lag. Er waren in 2017 maar 2 stammen (2%) die niet vergezeld gingen van een officiële melding, wat lager is dan de 6% in de 4 voorgaande jaren (2016: 6/96; 2015: 4/72; 2014: 6/95; 2013: 5/79). Dit is in ieder geval deels te verklaren door de uitbraak, waardoor er extra aandacht en inspanningen waren om zoveel mogelijk informatie te verzamelen.
In 2016 werden 7 zwangere vrouwen met listeriose gemeld, wat vergelijkbaar was met 2012 (n=6) en 2011 (n=9). In 2017 werden, evenals in 2013-2015, 3 zwangere vrouwen in een jaar gemeld. Twee van de 3 zwangerschappen eindigden in een doodgeboorte. Van de volwassenen overleden 10 personen (9%), vergelijkbaar met 2016 (9%) en 2013-2014 (10%), maar lager dan in 2015 (15/68 (22%)).
Vooral mensen met onderliggend lijden zijn gevoelig voor infecties met L. monocytogenes en hebben een grotere kans op een ernstig beloop van de infectie. (4, 5) Maagzuurremmers worden gezien als veilige medicatie en ook door mensen zonder ernstig onderliggend lijden gebruikt. De meerderheid van de listeriosepatiënten slikt maagzuurremmers. Een eerdere patiëntcontrolestudie uitgevoerd op de Nederlandse data liet zien dat dit mogelijk het risico op listeriose verhoogt. (6) In een groot patiëntcontroleonderzoek in Denemarken met 721 patiënten en 34844 gematchte controles, werd een onderscheid gevonden naar type maagzuurremmers (7). Gebruik van protonpompremmers in de 90 dagen ervoor was significant geassocieerd met listeriose, terwijl dit niet werd gevonden voor H-2- antagonisten. Mogelijke verklaring voor het verhoogde risico is de verminderde productie van maagzuur, waardoor bacteriën een grotere kans hebben om de passage door de maag te overleven.
Sinds 2017 is typering van de humane isolaten door PFGE vervangen door WGS. Ook de voedselisolaten worden sinds 2017 standaard gesequenced. WGS heeft een beter onderscheidend vermogen, geeft beter inzicht in stammen die maar iets van elkaar verschillen en is over het algemeen sneller beschikbaar dan PFGE. (8, 9) Deze wijziging in clusterdetectie heeft in dit eerste jaar niet geleid tot het vinden van meer of minder clusters dan bij gebruik van PFGE. De data van 1 jaar leveren echter weinig vergelijkingsmateriaal op. Via een Europese studie, ELiTE, zijn de humane isolaten uit de periode 2010-2016 gesequenced. Ook de voedselisolaten van 2016 en een deel van 2014-2015 zijn ondertussen gesequenced. Er is een start gemaakt om alle Nederlandse data van zowel voedsel als patiënten samen te voegen om retrospectief een vergelijking over meerdere jaren te maken. Voornaamste doel hierbij is om typen te identificeren die over de jaren terugkomen en matchen tussen humaan en voedsel. Dit zou indicatief zijn voor langdurige (industriële) bronnen van besmetting. WGS data van het RIVM en de NVWA worden real-time bijeen gebracht in een database waardoor in het geval van verheffingen wellicht sneller naar een bron is toe te werken.
Wij bedanken alle GGD’en en medisch microbiologische laboratoria hartelijk voor hun medewerking bij de verzameling van de patiëntengegevens en het insturen van isolaten. Verder gaat onze dank uit naar alle patiënten voor hun medewerking bij het beantwoorden van de vragen onder vaak moeilijke omstandigheden. Tenslotte bedanken we de personen binnen het RIVM (met name Ramon Noomen) voor hun werk aan de isolatie en typering van Listeria monocytogenes, de onderzoeksondersteuners van het laboratorium Voeder- en Voedselveiligheid van de NVWA voor het onderzoeken van de monsters en Redmar van den Berg voor de WGS-data-analyse van voedselisolaten.
Auteurs
I.H.M. Friesema1, S. Kuiling1, M.E.O.C. Heck1, M. van der Voort2, E.G. Biesta-Peters, W. Freudenburg-de Graaf3, A. van der Ende3, E. Franz1
- Centrum Infectieziektebestrijding, RIVM, Bilthoven
- Nederlandse Voedsel en Waren Autoriteit (NVWA), Divisie Handhaving
- Afdeling Medische Microbiologie, Nederlands Referentielaboratorium voor Bacteriële Meningitis, Amsterdam UMC, Universiteit Amsterdam
Correspondentie
Literatuur
- Maertens de Noordhout C., Devleesschauwer B., Angulo F.J., et al. The global burden of listeriosis: a systematic review and meta-analysis. The Lancet Infectious diseases 2014; 14: 1073-82.
- Chlebicz A., Slizewska K. Campylobacteriosis, Salmonellosis, Yersiniosis, and Listeriosis as Zoonotic Foodborne Diseases: A Review. International Journal of Environmental Research and Public Health 2018; 15.
- ECDC. Disease data from ECDC Surveillance Atlas - listeriosis. 2017. (Accessed 2018).
- Ramaswamy V., Cresence V.M., Rejitha J.S., et al. Listeria - Review of epidemiology and pathogenesis. J Microbiol Immunol Infect 2007; 40: 4-13.
- Drevets D.A., Bronze M.S. Listeria monocytogenes : Epidemiology, human disease, and mechanisms of brain invasion. FEMS Immunol Med Microbiol 2008; 53: 151-65.
- Friesema I.H., Kuiling S., van der Ende A., Heck M.E., Spanjaard L., van Pelt W. Risk factors for sporadic listeriosis in the Netherlands, 2008 to 2013. Euro Surveill 2015; 20: pii: 21199.
- Kvistholm Jensen A., Simonsen J., Ethelberg S. Use of Proton Pump Inhibitors and the Risk of Listeriosis: A Nationwide Registry-based Case-Control Study. Clin Infect Dis 2017; 64: 845-51.
- Moura A., Tourdjman M., Leclercq A., et al. Real-Time Whole-Genome Sequencing for Surveillance of Listeria monocytogenes, France. Emerg Infect Dis 2017; 23: 1462-70.
- Lüth S., Kleta S., Al Dahouk S. Whole genome sequencing as a typing tool for foodborne pathogens like Listeria monocytogenes - The way towards global harmonisation and data exchange. Trends in Food Science & Technology 2018; 73: 67-75.
Infectieziekten Bulletin, jaargang 29, nummer 11, december 2018