Salmonella in Nederland in 2017

Sinds het begin van deze eeuw is het aantal humane gevallen van salmonellose meer dan gehalveerd en is in 2017 het laagste ooit. Dit wordt gereflecteerd door bevindingen in de surveillance van landbouwhuisdieren en van vlees in de detailhandel. De bestrijdingsprogramma’s bij landbouwhuisdieren en verbeteringen in de hygiëne van het voedselproductie proces hebben dus effect gehad. In de periode 2013 tot en met 2017 was de incidentie van bevestigde salmonellose gevallen 8,9-9,3 per 100.000 inwoners, met naar schatting 27.440 patiënten met acute gastro-enteritis door salmonella-infecties in de bevolking in 2017. Dit betekent dat Nederland een van de laagste incidenties van Europa heeft.
Sinds de jaren 80 wordt door het Rijksinstituut voor Volksgezondheid en Milieu (RIVM) een landelijke laboratoriumsurveillance uitgevoerd naar salmonellose in Nederland. De geschatte dekkingsgraad van de surveillance is 64% (1) van de Nederlandse bevolking. Incidentele gevallen van salmonellose bij mensen zijn in Nederland, in tegenstelling tot diverse andere Europese landen, niet meldingsplichtig. Salmonellose is alleen meldingsplichtig indien er een cluster is van 2 of meer gerelateerde patiënten die ziek werden na consumptie van besmet voedsel of drinkwater. Trends van Salmonella bij de mens worden het best beschreven in relatie tot hun bronnen. Als Nationaal Referentie Centrum voor Salmonella ontvangt het RIVM ook isolaten voor typering van runderen, varkens, pluimvee en huisdieren, inclusief reptielen. Daarnaast worden isolaten getypeerd uit andere landbouwhuisdieren zoals paarden, geiten, schapen en eenden, en uit omgevingsmonsters en voedingsmiddelen. De isolaten komen uit verschillende monitoringprogramma’s op boerderijen, slachthuizen en supermarkten. Vaak zijn deze programma’s onderdeel van het werk van de Gezondheidsdienst voor Dieren (GD) en de Nederlandse Voedsel en Waren Autoriteit (NVWA), maar isolaten worden ook ingestuurd door dierentuinen, de diergeneeskundefaculteit en diervoederindustrie. Periodiek worden de gegevens over Salmonella bij mensen zoals serotypering, moleculaire typering en resistentie (bepaald door Wageningen Bioveterinary Research (WBVR), Lelystad), verstuurd naar het European Centre for Disease Control (ECDC). Deze gegevens zijn nu beschikbaar voor het publiek, geaggregeerd op serotype, leeftijd, geslacht, periode en land.(2) Vergelijkbare gegevens over landbouwhuisdieren en voedsel worden jaarlijks verstuurd naar de European Food Safety Authority (EFSA). In de bijlages zijn álle serotypes getabelleerd, gevonden tussen 2000 en 2017 in de mens, en die voor landbouwhuisdieren gevonden tussen 2005 en 2017. In de tabellen 1 en 3 staan de belangrijkste serotypes.
Tabel 1 De ontwikkeling van de belangrijkste salmonellaserotypen in de mens. Serotypen waar significante verheffingen voor zijn gevonden zijn grijs gearceerd (c.f. Tabel 2 en Figuur 1). (Bron: Laboratoriumsurveillance RIVM, met dekkingsgraad ~64% van Nederland).
| Serotype | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | Reizen |
| Totaal aantal | 2204 | 994 | 986 | 979 | 1160 | 968 | 12% |
| Enteritidis | 421 | 256 | 213 | 239 | 319 | 244 | 16% |
| Typhimurium-monof. 1,4,5,12:i:- | 321 | 158 | 207 | 156 | 197 | 172 | 4% |
| Typhimurium | 276 | 185 | 166 | 196 | 208 | 161 | 5% |
| Thompson | 803 | 25 | 7 | 5 | 7 | 4 | 3% |
| Infantis | 22 | 30 | 26 | 35 | 26 | 38 | 10% |
| Kentucky | 11 | 17 | 6 | 9 | 31 | 26 | 29% |
| Napoli | 7 | 14 | 11 | 14 | 23 | 10 | 9% |
| Dublin | 4 | 6 | 22 | 15 | 20 | 6 | 3% |
| Bovismorbificans | 14 | 6 | 6 | 5 | 34 | 18 | 6% |
| Newport | 20 | 12 | 12 | 9 | 11 | 18 | 21% |
| Derby | 10 | 11 | 15 | 12 | 16 | 8 | 7% |
| Brandenburg | 11 | 15 | 20 | 7 | 9 | 6 | 6% |
| Paratyphi B. var. Java | 6 | 10 | 7 | 13 | 26 | 17 | 34% |
| Stanley | 16 | 12 | 7 | 16 | 9 | 11 | 37% |
| Typhi, Paratyphi A, B | 15 | 20 | 20 | 12 | 16 | 15 | 30% |
| Heidelberg | 3 | 4 | 31 | 4 | 3 | 1 | 9% |
| SI 4,5,12:b:- | 4 | 10 | 7 | 8 | 13 | 13 | 22% |
| Agona | 8 | 5 | 6 | 9 | 13 | 6 | 33% |
| Chester | 2 | 3 | 12 | 11 | 12 | 10 | 16% |
| Oranienburg | 9 | 3 | 6 | 16 | 5 | 5 | 19% |
| Hadar | 8 | 7 | 5 | 13 | 4 | 4 | 27% |
| SI 9,12:l,v:- | 5 | 6 | 23 | 3 | 1% | ||
| Weltevreden | 4 | 2 | 1 | 2 | 7 | 4 | 41% |
| Virchow | 9 | 10 | 9 | 5 | 8 | 8 | 30% |
| Andere serotypes (#serotypes) | 195 (91) | 167 (87) | 141 (86) | 165 (75) | 143(77) | 163(76) | 22% |
Ziektelast
Diverse epidemiologische onderzoeken in de afgelopen 20 jaar hebben het mogelijk gemaakt om op basis van de laboratoriumbevindingen te schatten hoeveel mensen in de algemene bevolking acute gastro-enteritis krijgen door Salmonella, daarmee naar de huisarts gaan, in het ziekenhuis belanden en komen te overlijden. Ook de ziektelast in verloren gezonde levensjaren, ook wel Disability Adjusted Life Years (DALY’s), en Cost of Illness (COI) kunnen zo geschat worden. Voor 2015-2017 wordt het aantal patiënten met acute gastro-enteritis door salmonella-infecties in de bevolking geschat op ruim 27.000. Dit komt overeen met ongeveer 1200 DALY’s; de COI komt neer op € 19 miljoen.(3,4) De DALY’s en COI kwamen in 2016 hoger uit maar dit is volledig toe te schrijven aan 2 grote internationale salmonella-uitbraken. Ter vergelijk, voor Campylobacter is het aantal patiënten met acute gastro-enteritis en DALY en COI ongeveer 3 maal zo hoog als voor Salmonella; het aantal ziekenhuisopnames is vergelijkbaar. Voor salmonella-infecties wordt geschat dat, naast reizen, milieucontact en mens-op-mensoverdracht, ongeveer 80% door voedsel komt; bij campylobacter-infecties wordt ongeveer een derde veroorzaakt door voedsel.
Trends in salmonellose bij mensen
In 2017 was het aantal ingestuurde salmonella-isolaten van patiënten in Nederland lager dan in 2016 en vergelijkbaar met 2014 en 2015; binnen de laboratoriumsurveillance werden 968 isolaten ingestuurd. Gecorrigeerd voor de dekkingsgraad van 64% zijn dat landelijk ongeveer 1.513 isolaten (Figuur 1, Tabel 1). Dit is een verdere stabilisatie na een lange periode van geleidelijke afname, onderbroken door jaren met grote infectieziekte-uitbraken zoals die in 2003, 2006, 2008, 2010, 2012 en ook 2016. In 2003 was er een uitbraak door besmette eieren uit Spanje tijdens de vogelpest. In 2006, 2008 en 2010 waren grote uitbraken met verschillende besmettingsbronnen en in 2012 was een grote uitbraak (> 1.100 geregistreerde patiënten) veroorzaakt door het eten van met S. Thompson besmette gerookte zalm, (Figuur 1, Tabel 1).(5) In 2016 werd de verheffing, die verder doorliep in 2017, vooral veroorzaakt door een grote internationale uitbraak van Salmonella enteritidis (in Nederland voornamelijk de MLVA-types 02-09(10,11)-07-03-02). Deze uitbraak was gerelateerd aan Poolse eieren die geleverd waren aan restaurants (202 geregistreerde patiënten in 2016 en nog eens 35 in 2017).(6) Een wat kleinere infectieziekte-uitbraak die begon in 2016 en doorliep tot eind maart 2017 in Nederland en België, werd veroorzaakt door Salmonella bovismorbificans (n=53) in rauwehamproducten uit België. (7) Bij het bestrijden van beide uitbraken speelde whole genome sequencing (WGS) een sleutelrol in de genetische afgrenzing van de betrokken clusters. Een uitbraak onder jong volwassenen aan de Duitse grens was vermoedelijk veroorzaakt door het eten van junkfood besmet met de monofasische Salmonella typhimurium (MLVA type 03-12-09-00-211, n=21). Onder de bewoners van een verpleeghuis was sprake van infecties door het in Europa opkomende ciprofloxacineresistente serotype S. Kentucky (n=14). Doorgaans worden besmettingen met dit serotype alleen bij reizigers gevonden. Van enkele kleinere verheffingen zoals S. Infantis (n=14), S. Agbeni (n=10) en S. Newport (n=8) kon geen bron worden gevonden.
Het aantal patiënten waarvoor laboratoriumdiagnostiek wordt uitgevoerd is meestal het topje van de ijsberg; het werkelijke aantal individuele patiënten met salmonellose en diegenen horend bij uitbraken, ligt naar schatting ruim 15 maal zo hoog.(2)
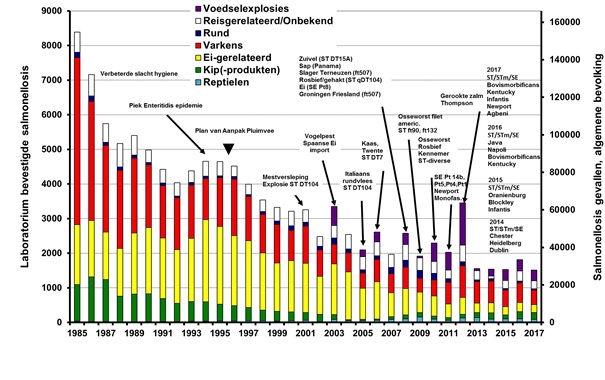
Figuur 1 Geschatte bijdrage aan de laboratoriumbevestigde salmonellose bij mensen (linker y-as) door reizen (of onbekend), landbouwhuisdieren of hun producten. Omvangrijke verheffingen die niet representatief zijn voor de salmonellastatus van de Nederlandse vee- en pluimveestapel, zijn in paars aangegeven. (Bron: Laboratoriumsurveillance RIVM).
Tijdreeksanalyse en analyse van geografische clustering brengen meer mogelijke uitbraken aan het licht dan de GGD en NVWA signaleren.(8,9) In 2013 was het geschatte aandeel van geclusterde patiënten met 4% heel laag terwijl dit ten tijde van de uitbraak door besmette zalm in 2012 bijna 50% was. In 2015, 2016 en 2017 met respectievelijk 22%, 25% en 19% was dit meer dan in 2013 en 2014 maar vergelijkbaar met de jaren voor 2012 (Tabel 2). Ook het aantal vermoedelijke kleine uitbraken en daarbij betrokken patiënten was in 2015, 2016 en 2017 hoger dan in 2013 en 2014: respectievelijk 15 (waarvan 5 geografisch geclusterd), 17 (waarvan 10 geografisch geclusterd) en 23 (waarvan 6 geografische geclusterd). In de afgelopen jaren werden door het jaar heen diverse regionaal verspreide clusters gezien door S. typhimurium, met name van de monofasische variant en ook van S. enteritidis.
Tabel 2 Regionale en diffuse uitbraken geconstateerd binnen de Laboratorium Surveillance RIVM (dekkingsgraad ~64%) en het aantal betrokken (extra) patiënten met salmonellose dan verwacht in de periode van het cluster.
| 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | |
| Totaal (regionaal) | 20(5) | 5(2) | 11(4) | 15(5) | 17(10) | 23(6) |
| Isolaten (% in clusters) | 2207(49%) | 995(4%) | 985(13%) | 978 (22%) | 1158(25%) | 968(19%) |
| Aantal cases in clusters (excess) | 1278(1091) | 63(41) | 178(125) | 374(217) | 319(285) | 251(181) |
Binnen de serotypen S. typhimurium en S. enteritidis is de MLVA-typering (Multiple-Locus Variable tandem repeat Analysis) heel geschikt om clusters van patiënten te onderscheiden met een mogelijk gemeenschappelijke besmettingsbron. Sommige clusters werden ook in het buitenland gesignaleerd in het Epidemic Intelligence Information System (EPIS) van het ECDC. (10) Eind 2015 is gestart met onderzoek van clusters met WGS, en met succes wat blijkt uit bovengenoemde uitbraken in 2016 en 2017.
Surveillance van serotypes bij de mens, landbouwhuisdieren en in voedsel
In 60-80% van alle ingestuurde patiëntisolaten werden de salmonellaserotypen enteritidis en typhimurium (inclusief de monofasische) aangetoond (Tabel 1); deze typen waren ook dominant bij landbouwhuisdieren (Tabel 4). In tegenstelling tot S. enteritidis waren de problemen met S. typhimurium meestal niet aan reizen gerelateerd (Tabel 1). Op de derde plaats van de meest voorkomende serotypen bij de mens staat het sterk opkomende antigeentype S. enterica subsp. enterica (subgroep I) serovar 1,4,5,12:i. Het aantal isolaten met dit antigeentype steeg van 27 in 2005, naar 321 in 2012, waarna dit weer daalde tot ongeveer de helft in 2017. Ook bij varkens en in mindere mate bij runderen nam dit type nog sterk toe tot in 2017, terwijl dit bij de mens in 2017 was gehalveerd ten opzichte van 2012. Al langere tijd wordt dit type ook gevonden in pluimvee. Het is een monofasische variant van S. typhimurium en is in vele landen emerging. Het voor de mens niet-tyfeuze serotype S. paratyphi B var. Java was het dominante type in kippenvlees (sinds 2014 S. infantis). Toch wordt dit multiresistente type, dat soms zelfs Extended Spectrum Beta Lactamase (ESBL) produceert, weinig bij de mens gevonden (7 in 2014, 13 in 2015) en is dan vaak aan reizen gerelateerd (naar schatting 50%) (Tabel 1). Echter met 26 keer in 2016 en 17 keer in 2017 was het aantal nog nooit zo hoog. Tot in 2013 werd in ongeveer 50% van de isolaten van pluimveevlees uit de winkel S. paratyphi B var. Java gevonden. Dit percentage is in 2014 voor het eerst lager, een trend die zich voortzette tot in 2017 (Tabel 3 en 4).
Tabel 3 Salmonella spp. in kippenvlees in de detailhandel (monitoringsprogramma NVWA).
| 1997 - 2005 | 2006 - 2010 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | |||||||
| V | VB | V | VB | V | VB | V | VB | V | VB | V | VB | |||
| Samplegrootte | 12.348 | 6.846 | 564 | 672 | 600 | 595 | 586 | 632 | 593 | 674 | 208 | 269 | 231 | 251 |
| % Salmonella spp. | 15,8 | 7,3 | 6,6 | 5,4 | 3,2 | 3,2 | 3,9 | 2,7 | 3,9 | 3,6 | 2,4 | 1,9 | 3,0 | 1,6 |
| Paratyphi B Java (%) | 32,7 | 59,6 | 43 | 52,8 | 53 | 42,1 | 44 | 29,4 | 26 | 20,8 | 20 | 20 | 14 | |
| Enteritidis (%) | 11,4 | 5,8 | 11 | 5,6 | 11 | 31,6 | 4,3 | |||||||
| Hadar (%) | 4,4 | 2,7 | ||||||||||||
| Indiana (%) | 7,5 | 3 | 5,9 | |||||||||||
| Infantis (%) | 7,3 | 10 | 41 | 36,1 | 26 | 21,1 | 52 | 58,8 | 57 | 70,8 | 60 | 40 | 57 | 75 |
| Virchow (%) | 5,5 | 4,2 | 40 | |||||||||||
| Typhimurium (%) | 4,9 | 0,8 | 2,8 | 5,3 | 4,3 | |||||||||
| Andere types (%) | 26,3 | 13,9 | 5,5 | 2,7 | 5,3 | 5,2 | 4,3 | 5,9 | 8,8 | 8,4 | 29 | 25 | ||
Tabel 4 De serotypedistributie van de meest voorkomende salmonellatypen in landbouwhuisdieren (Bron: Laboratorium surveillance RIVM). Een volledige lijst serotypen, 2005-2017 is als bijlage verkrijgbaar. (V=vlees, VB = vleesbereiding)
| Serotypes | 2011-2015 | 2016 | 2017 | |||||||||
| Varken | Rund | Slacht-kuiken | Leghen | Varken | Rund | Slacht-kuiken | Leghen | Varken | Rund | Slacht-kuiken | Leghen | |
| Totaal aantal | 762 | 311 | 736 | 309 | 63 | 58 | 98 | 112 | 163 | 80 | 160 | 24 |
| Typhimurium | 258 | 120 | 21 | 26 | 14 | 16 | 1 | 2 | 56 | 28 | 7 | 4 |
| SI 1,4,5,12:i:- | 207 | 55 | 27 | 14 | 33 | 14 | 13 | 3 | 86 | 10 | 5 | 7 |
| Enteritidis | 2 | 3 | 58 | 140 | 3 | 39 | 85 | 1 | 6 | 5 | ||
| Paratyphi B var. Java | 2 | 1 | 190 | 10 | 1 | 9 | 2 | 1 | 22 | |||
| Heidelberg | 131 | 2 | 73 | |||||||||
| Infantis | 12 | 1 | 121 | 8 | 1 | 20 | 2 | 1 | 10 | |||
| Derby | 140 | 10 | 3 | 5 | 5 | |||||||
| Dublin | 97 | 1 | 2 | 1 | 17 | 1 | 27 | |||||
| Brandenburg | 39 | 3 | 8 | 1 | 4 | 3 | 1 | 2 | 1 | 5 | ||
| Goldcoast | 38 | 7 | 3 | 1 | 1 | 2 | 1 | 1 | ||||
| Livingstone | 12 | 14 | 6 | 1 | 2 | |||||||
| Braenderup | 3 | 29 | ||||||||||
| Minnesota | 26 | 1 | 1 | 1 | 3 | |||||||
| Agona | 1 | 14 | 11 | 1 | 1 | |||||||
| Indiana | 2 | 22 | 1 | 2 | ||||||||
| Mbandaka | 1 | 12 | 5 | 2 | 1 | |||||||
| Anatum | 5 | 5 | 3 | 1 | 3 | |||||||
| Rissen | 8 | 2 | 3 | 2 | ||||||||
| Montevideo | 6 | 3 | 1 | 3 | 1 | |||||||
| Jerusalem | 1 | 2 | 4 | 5 | ||||||||
| Newport | 8 | 1 | 1 | 1 | 1 | |||||||
| Schwarzengrund | 1 | 2 | 8 | |||||||||
| Overig (59 serotypes) | 38 | 7 | 62 | 43 | 1 | 2 | 9 | 7 | 9 | 6 | 10 | 7 |
Een belangrijk deel van de afname van salmonella-infecties bij de mens lijkt te kunnen worden verklaard door het salmonellabestrijdingsprogramma voor pluimvee (Figuur 2). In alle schakels van de productieketen toont zowel de monitoring van de vroegere Productschappen Vee, Vlees & Eieren (PVE) (gestopt na 2012) als de monitoring van de NVWA in de detailhandel (Tabel 3) een aanzienlijke afname van het aantal salmonellabesmettingen. Vanaf 2011 is ook gekeken in vleesbereidingen (gekruid of gemarineerd vlees) en kippengehakt; hierin werden vergelijkbare besmettingspercentages aangetroffen als in onbereid kippenvlees.
Opmerkelijk bij landbouwhuisdieren is de toename van het monofasische type van S. typhimurium, de kentering van de toename van S. Derby bij varkens en S. paratyphi B var. Java bij slachtkuikens en de sterke toename van S. infantis in kippenvlees (Tabellen 3 en 4).
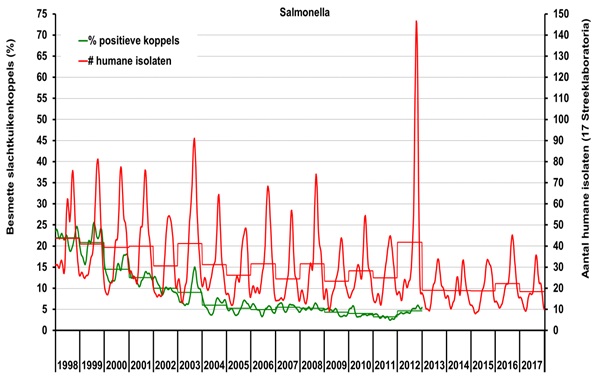
Figuur 2 Seizoens- en jaartrend (stappenlijn) van het wekelijkse voorkomen van patiënten met salmonellose (Bron: Surveillance in de voormalige streeklaboratoria, RIVM) (rechter-as) en het percentage salmonella-positieve slachtkuikenkoppels bij de slacht. (Bron: monitoring PVE) (linker-as).
Levensmiddelenonderzoek
De NVWA onderzoekt jaarlijks voor een groot aantal levensmiddelen of zij voldoen aan de gestelde norm van afwezigheid van Salmonella.
In Tabel 3 staat een overzicht van het onderzoek in de detailhandel van kippenvlees, waarbij voor vers kippenvlees een afwezigheidsnorm alleen geldt voor de 2 meest voorkomende serotypes bij mensen: S. enteritidis en S. typhimurium. In vleesbereidingen van pluimveevlees mag geen enkel salmonellaserotype worden aangetroffen.• In circa 2% van de monsters van vers vlees- en vleesbereidingen van kip is in 2017 Salmonella gevonden. Hierbij is het percentage voor vers vlees hoger dan voor vleesbereidingen, met respectievelijk 3,0% en 1,6% dat positief bevonden werd voor Salmonella.• In 52 partijen geïmporteerd kipvlees bereidingen werd in 9 partijen Salmonella gevonden (17,3%). Dit betrof 5x S. Heidelberg, 5x S. typhimurium, 1x S. Minnesota en 1x S. Mbandaka.
In Tabel 5 is een overzicht gegeven van de overige soorten (rauw) vlees afkomstig uit de detailhandel die werden onderzocht. Het gaat hier om vers vlees en, vleesbereidingen van rund of kalf, varken en schaap of lam. (11) Hoewel er geen normen voor Salmonella gelden voor vers vlees van deze diersoorten, volgt de NVWA wel het voorkomen van onder andere Salmonella in dit type product; in gehakt vlees, vleesbereidingen en producten mag geen Salmonella zitten. (12)• In vers varkensvlees is de prevalentie van 0,4% in 2016 en 0,7% in 2017 opmerkelijk laag (voorheen tussen 1 en 4%), terwijl deze voor lam met 1,8% in 2016 en 1,0% ook nog in 2017 juist hoog is in vergelijking met voorgaande jaren (voorheen slechts incidenteel).• In vers rund/kalfsvlees is het percentage positieven al jaren niet meer dan 0,5% (in 2017 0,2%). In 290 partijen gehakt en vleesbereidingen (anders dan pluimvee) werd 3 keer Salmonella gevonden: S. paratyphi B var. Java in rund; S. Goverdhan in varken en S. typhimurium in kalf.• In 281 partijen rauw te consumeren vlees, zoals filet américain, ossenworst en tartaar, werd 1x Salmonella gevonden: S. Dublin in ossenworst.• Bij de groothandel wordt exotisch vlees bemonsterd, zoals kangoeroe, struisvogel, krokodil en kikker(billen). In 6 van de 46 onderzochte partijen is Salmonella gevonden: in 4 van de 5 monsters kikkerbillen, in 1 van 13 monsters kangoeroevlees en in 1 van 4 monsters krokodil.
Tabel 5 Salmonella in 25 g rauw vlees in de detailhandel. (Bron: Monitoringprogramma NVWA)
| 2006-2012 | 2013 | 2014 | 2015 | 2016 | 2017 | |||||||
| N | % + | N | % + | N | % + | N | % + | N | % + | N | % + | |
| Rund en Kalf | 6155 | 0,9 | 433 | 0,5 | 420 | 0,0 | 488 | 0,0 | 507 | 0,4 | 504 | 0,2 |
| Filet americain | 4883 | 0,4 | -- | -- | -- | -- | -- | -- | 99 | 1,0 | 105 | 0,0 |
| Osseworst | 699 | 0,3 | -- | -- | -- | -- | -- | -- | 59 | 0,0 | 75 | 1,3 |
| Varken | 4779 | 1,8 | 704 | 4 | 763 | 1,3 | 788 | 0,9 | 271 | 0,4 | 278 | 0,7 |
| Lam | 881 | 0,5 | 52 | 0 | 31 | 0,0 | 49 | 0,0 | 112 | 1,8 | 196 | 1,0 |
Ook voor levensmiddelen waarvan de verwachting is dat ze zonder afdoende verhitting geconsumeerd kunnen worden geldt dat er geen Salmonella in mag zitten.• Net als in 2015 en 2016 was de besmetting met Salmonella in kruiden/specerijen het hoogst. Hierbij waren 2 van de 37 partijen geïmporteerde verse kruiden (5,4%) positief voor Salmonella; voor sesamzaad waren van 186 partijen 8 positief (4,3%, in 2016 3,5%). In vrijwel geen van de bijna 300 monsters van gedroogde kruiden/specerijen werd Salmonella aangetoond (in 2016 0,7%).• In tweekleppigen werd in 1 van de 320 monsters (Franse venusschelpen) een S. typhimurium geïsoleerd.• Bij ingevroren geïmporteerde gekweekte vis en tropische garnalen werd in 1 van de 18 monsters garnalen een S. Brunei gevonden. In de 18 monsters Tilapia en 20 monsters Pangasius werd geen Salmonella aangetoond.• In 600 monsters verse groenten en maaltijdsalades, waarvan 274 met kiemgroenten, 134 met gerookte vis en 107 met garnalen uit de detailhandel, werd geen Salmonella gevonden.
Naast de surveillance van voedsel doet de NVWA ook onderzoek naar de aanwezigheid van Salmonella naar aanleiding van klachten of bij uitbraken die mogelijk veroorzaakt zijn door het eten van met Salmonella besmet voedsel.(9) In 2017 was dit het geval toen tijdens 2 uitbraken links gelegd konden worden met respectievelijk besmette Poolse eieren en rauwehamproducten (zie Trends in salmonellose bij mensen).
Reservoirs en bronnen van besmetting
Ongeveer 80% van de salmonella-infecties is het gevolg van het eten van besmet voedsel zoals onvoldoende verhitte eieren, rauwe vleesproducten en incidenteel door (voorgesneden) rauwe groenten en fruit. De geschatte bijdrage aan de humane salmonellose door reizen, landbouwhuisdieren en hun producten wordt getoond in Figuur 1. Uit de frequentiedistributie van serotypen bij de bronnen, wordt de frequentiedistributie van serotypen bij de mens geschat. Daarbij betrekt men ook het geconsumeerde volume, de besmettingsgraad en de fractie van het voedsel wat rauw of goed doorbakken wordt geconsumeerd.(13,14) Ook wordt het deel meegenomen dat wordt veroorzaakt door reptielen die als huisdier worden gehouden en waarbij besmetting optreedt via direct contact met de dieren of contact met een besmette omgeving (terrarium). (15)• Tot 5 jaar geleden waren eieren de belangrijkste bron van salmonellose, net als in andere Europese landen. Sinds 2009 geldt dat eieren die afkomstig zijn van S. enteritidis/S. typhimurium-positieve koppels (kippen die met elkaar in 1 hok zitten), niet meer op de markt gebracht mogen worden als tafeleieren voor directe humane consumptie (EG-besluit 1237/2007). Zij zijn alleen geschikt voor de eiverwerkende industrie waarbij de bacterie wordt gedood.• Het aantal aan eieren gerelateerde infecties was in de afgelopen 35 jaar nooit zo laag als in 2017, namelijk ongeveer 15%. Voor varkens was dit in 2017 28%, slechts 2% was afkomstig van rund, 13% van kip.• 5% van de salmonella-infecties werd veroorzaakt door contact met reptielen. Salmonella is een commensale darmbacterie bij reptielen. (15) Het houden van reptielen was de laatste jaren sterk toegenomen. Het aantal hier aan toegeschreven infecties was vóór 2000 minder dan 1% en vooral kinderen in de leeftijd van 0-4 jaar werden ziek. Na 2000 steeg het aantal infecties tot ongeveer 8-9% en werden vooral volwassenen ziek. (16) Dit hield waarschijnlijk verband met de populariteit van kleine schildpadden als huisdier bij jonge kinderen (voor 2000) en de toenemende populariteit van reptielen als huisdier bij volwassenen (na 2000), vooral slangen. Om onduidelijke reden is het aantal salmonella-infecties door reptielen na 2015 sterk gedaald: 7% in 2016 en 5% in 2017.• Afhankelijk van het serotype werd minstens 12% van alle salmonella-infecties in het buitenland opgelopen (Tabel 1, Figuur 1).• Bij 4% van de infecties kon de besmettingsbron niet worden geschat.
Resistentieontwikkeling
De MARAN-rapportage over 2017 beschrijft de verdere toename van salmonellastammen die resistent zijn tegen fluoroquinolonen.(17) Het aantal salmonellastammen (bij mens en dier tezamen) dat resistent was tegen derdegeneratie-cefalosporines is vergelijkbaar met de 3 voorgaande jaren. Carbapenemresistentie is tot dusverre nog niet in Salmonella waargenomen, ook niet in 2017. Het overdraagbare colistineresistente gen mcr-1 werd ook in 2017 niet gevonden.(18) Deze antibiotica zijn van belang voor effectieve behandeling van ernstige infecties bij mensen. Multiresistentie werd het meeste gevonden bij S. Heidelberg (geïmporteerd kippenvlees), S. Kentucky (meestal reis- gerelateerde infecties), S. typhimurium (inclusief de monofasische variant), S. paratyphi B variant Java (in kippenvlees maar zelden bij de mens), S. infantis en in minder mate in S. Dublin (vrijwel uitsluitend in rund). Alleen bij de mens werden in 2017 isolaten verdacht van ESBL-productie gevonden (2,5%, 31/1222 van 7 serovars), vooral S. Kentucky (meestal reisgerelateerd) en S. typhimurium. Het percentage ESBL-producerende isolaten bij de mens neemt geleidelijk toe en was voor 2012 nog minder dan 1%. De enige ESBL-producerende salmonella-isolaten uit landbouwhuisdieren waren afkomstig van geïmporteerd kippenvlees (68% in 2017, voornamelijk S. Heidelberg (18) en werden niet gevonden in vers vlees en vleesbereidingen van zowel pluimvee als runderen, varkens of lammeren. Ciprofloxacineresistentie werd het meest aangetroffen in isolaten bij de mens en bij de kip. Net als in voorgaande jaren waren daarbij de serotypen S. enteritidis (22%), S. infantis (26%) en S. Kentucky (81%) dominant.
Conclusies
Sinds het begin van deze eeuw is het aantal mensen met salmonellose meer dan gehalveerd en is in 2017 het laagst ooit. Dit wordt gereflecteerd door de bevindingen in de surveillance van landbouwhuisdieren en van vlees in de detail- en groothandel. De bestrijdingsprogramma’s bij landbouwhuisdieren en verbeteringen in de hygiëne van het voedselproductieproces hebben dus effect gehad. In de periode 2013 tot en met 2017 was de incidentie patiënten met door laboratoriumonderzoek bevestigde salmonellose 8,9-9,3 per 100.000 inwoners, met naar schatting 27.440 patiënten met acute gastro-enteritis door salmonellose in de bevolking in 2017. Dit betekent dat Nederland een van de laagste incidenties van Europa heeft. De belangrijkste bron van salmonella-infecties bij mensen is varkensvlees (28%) met tafeleieren op een goede tweede plaats (15%). Deze gunstige ontwikkeling werd af en toe onderbroken door aan voedsel gerelateerde uitbraken met hoge directe/indirecte maatschappelijke kosten. Daarnaast blijft de ontwikkeling van antibioticaresistentie een bron van zorg, met name de multiresistentie en ESBL-productie in verschillende serotypen en de toename van salmonella-stammen die resistent zijn tegen fluoroquinolonen. Ook nieuwe besmettingsbronnen worden aangetoond. Bijvoorbeeld reptielen, die als huisdier gehouden worden en 5% van de infecties veroorzaken.
Auteurs
W. van Pelt1, M. van der Voort2, M-J. Mangen1, K. Veldman3, B. Wit2, E. Franz1, M. Heck1, R. Pijnacker1, I. Friesema1, L. Mughini-Gras11. Centrum Infectieziektebestrijding RIVM, Bilthoven2. Nederlandse Voedsel- en Warenautoriteit (NVWA), Utrecht3. Wageningen Bioveterinary Research (WBVR), Lelystad
Correspondentie
Literatuur
- Laboratory surveillance of bacterial gastroenteric pathogens in The Netherlands, 1991-2001. van Pelt W, de Wit MA, Wannet WJ, Ligtvoet EJ, Widdowson MA, van Duynhoven YTPH. Epidemiol Infect. 2003 Jun;130(3):431-41.
- ECDC. http://ecdc.europa.eu/en/data-tools/atlas/Pages/atlas.aspx.
- Mangen M-J, Friesema IHM, Pelt van W.(2018) Disease burden of food-related pathogens in the Netherlands, 2017. RIVM briefrapport, 2018. In preparation.
- Bouwknegt M, Friesema I, Mangen MJ, Van Pelt W, Havelaar A.(2015) De ziektelast van voedsel gerelateerde infecties in Nederland, 2009-2012. Infectieziekten Bulletin 2015, 26: 10-13.
- Friesema I, Jong A, Hofhuis A, Heck M, Kerkhof van den H, Jonge de R, Hameryck D, Nagel K, Vilsteren van G, Beek van P, Notermans D, Pelt van W.(2012) Large outbreak of Salmonella Thompson related to smoked salmon in the Netherlands, August to December 2012. Euro surveillance 10/2014; 19(39).
- Pijnacker R, Tijsma ASL, Friesema IHM, Voort van der M, Nijs de R, Slegers-Fitz-James IA, Heck MEOC, Kuiling S, Kerkhof van den JHCT, Leblanc JMJ, Franz E. Bronopsporing bij een langdurige internationale uitbraak van Salmonella Enteritidis. Infectieziekten Bulletin, 2017, 28(6): 181-187
- Brandwagt D, Wijngaard van den C, Tulen AD, Mulder AC, Hofhuis A, Jacobs R, Heck M, Verbruggen A, Kerkhof van den H, Slegers-Fitz-James I, Mughini-Gras L, Franz E. Outbreak of Salmonella Bovismorbificans associated with the consumption of uncooked ham roducts, the Netherlands, 2016 to 2017. Euro Surveill. 2018;23(1):pii=17-00335.
- Hulth A, Andrews N, Ethelberg S, Dreesman J, Faensen D,Pelt van W, Schnitzler J. Practical usage of computer-supported outbreak detection in five European countries. Euro Surveill. 2010 Sep 9;15(36). pii: 19658.
- Friesema IHM, Slegers-Fitz-James IA, Wit B, Franz E.(2018) Registratie voedselgerelateerde uitbraken in Nederland, 2017. 2018, RIVM Rapport 2018-0088.
- Gossner CM, et al. (2015) Event-based surveillance of food- and waterborne diseases in Europe: ‘urgent inquiries’ (outbreak alerts) during 2008 to 2013 Eurosurveillance 2015; 20(25).
- Definities van deze producten zijn bij wet vastgelegd in Verordening (EG) nr. 853/2004. http://eur-lex. europa.eu/legal-content/NL/TXT/?uri=uriserv:OJL_.2005.338.01.0027.01.NLD
- Verordening (EG) nr. 2073/2005 http://eur-lex.europa.eu/legal-content/NL/TXT/?uri=celex:32005R2073
- Mughini-Gras L, Enserink R, Friesema I, Heck M, Duynhoven van Y, Pelt van W.(2014) Risk factors for human salmonellosis originating from pigs, cattle, broiler chickens and egg laying hens: a combined case-control and source attribution analysis. PLoS ONE 2014; 9(2):e87933.
- Mughini-Gras L, Smid J, Enserink R, Franz E, Schouls L, Heck M, Pelt van W. (2014) Tracing the source of human salmonellosis: A multi-model comparison of phenotyping and genotyping methods. Infection, Genetics and Evolution 2014;28:251-260.
- Mughini-Gras L, Heck M, Pelt van W.(2016) Increase in reptile-associated human salmonellosis and shift toward adulthood in the age groups at risk, the Netherlands, 1985 to 2014. Eurosurveillance, 2016.
- Veldman KT, Wit B, Pelt van W, Heederik DJJ, Mevius DJ (Eds.).(2018) MARAN-2018 (i.c.m. NETHMAP-2018). http://www.cvi.wur.nl
- Veldman K, Essen-Zandbergen van A, Rapallini M, Wit B, Heymans R, Pelt van W, Mevius D.(2016) Location of colistin resistance gene mcr-1 in Enterobacteriaceae from livestock and meat. J Antimicrob Chemother. 2016 71(8):2340-2342. doi: 10.1093/jac/dkw181
- Liakopoulos A, Geurts Y, Dierikx CM, Brouwer MSM, Kant A, Wit B, Heymans R, Pelt van W, Mevius DJ.(2016) Extended-Spectrum Cephalosporin-Resistant Salmonella enterica serovar Heidelberg Strains, the Netherlands. Emerging Infectious Diseases, 2016 22(7):1257-1261.