Surveillance van STEC in Nederland in 2017

Shigatoxineproducerende Escherichia coli (STEC) is een bacterie die maag-darmklachten kan veroorzaken met symptomen variërend van diarree tot hemorragische colitis en het hemolytisch-uremisch syndroom (HUS).(1) STEC is een zoönose met herkauwers - vooral runderen - als belangrijkste reservoir. (2) STEC-infecties zijn vaak het gevolg van de consumptie van besmet voedsel, maar transmissie via het milieu lijkt ook belangrijk. (2, 3) Acute STEC-infecties zijn meldingsplichtig onder de Wet publieke gezondheid (Wpg), vanwege de ernst van de ziekte, vooral bij kleine kinderen en ouderen, en het risico op grootschalige uitbraken. In dit artikel presenteren we de resultaten van de surveillance voor het jaar 2017.
Methoden
Sinds juli 2016 gelden de nieuwe meldingscriteria voor STEC. (4) Bij diagnostiek met behulp van een PCR-test (Polymerase Chain Reaction), waarbij het laboratorium onderscheid kan maken naar shigatoxine genen (stx1- en stx2-genen) en kan testen op EscV -of E. coli attaching-and-effacing genen (eae-gen), hoeven patiënten waarbij het stx1-gen wordt aangetoond alleen gemeld te worden als ook het EscV- of eae-gen aanwezig is, aangezien stx1 zonder deze genen niet geassocieerd is met ernstige ziekte; voor aanwezigheid van het stx2-gen geldt deze voorwaarde niet. In geval van kweek gelden geen extra voorwaarden. Verder is de meldingsplicht vernauwd tot acute infecties (maximaal 21 dagen tussen eerste ziektedag en afnamedatum) met in ieder geval diarree, braken en/of bloed in de ontlasting. De aparte, langere vragenlijst is in Osiris geïntegreerd, maar wordt alleen zichtbaar als de infectie in Nederland (of onbekend) is opgelopen. De meldingscriteria in het geval van STEC-HUS zijn niet gewijzigd.
Daarnaast kunnen de laboratoria STEC positieve E. coli-kolonies die voldoen aan de meldingscriteria, opsturen naar het RIVM. Op het RIVM worden alle ingestuurde STEC-isolaten met behulp van PCR getest op de aanwezigheid van de belangrijkste virulentiegenen (stx-genen, eae-gen en het EHEC-hemolysine gen (EHEC-hly-gen)). Als er virulentiegenen aangetoond kunnen worden, vindt vervolgens O-serotypering en H-typering plaats en wordt het isolaat ingestuurd voor whole-genome sequencing (WGS). De WGS-data worden vervolgens gebruikt voor clusterdetectie door middel van core-genome multi-locus sequence typing (CgMLST) en in silico analyses zoals serotypering (wordt momenteel gevalideerd met klassieke serotypering). De cgMLST-clusterdetectie vervangt de Pulsed Field Gel Electrophoresis analyse (PFGE) die sinds 2017 niet meer wordt uitgevoerd.
Bij een vermoeden van een bron uit levensmiddelen of landbouwhuisdieren wordt contact opgenomen met de Nederlandse Voedsel- en Warenautoriteit (NVWA) voor monstername van levensmiddelen en/of bemonstering van dierlijke bronnen of omgeving voor onderzoek naar STEC, en typering van eventuele isolaten. Daarnaast onderzoekt de NVWA jaarlijks in het kader van diverse monitoringsprojecten, relevante producten op de aanwezigheid van STEC en test gevonden stammen op aanwezige stx-genen, aanhechtingsgenen (eae, aggR+aaiC) en bepaalt het serotype. De methoden bij het onderzoek van de NVWA zijn gebaseerd op ISO-methode 13136 en de diverse typerings PCRs van het EURL-VTEC. De methode voor de detectie van stx2f is gebaseerd op Derzelle et al.(5)
Resultaten
Patiënten
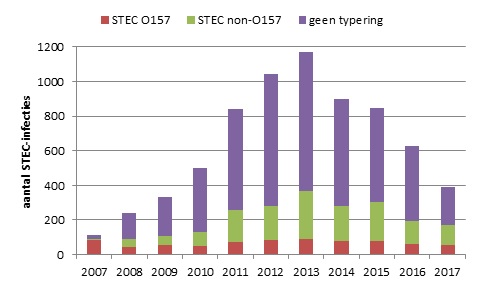
In 2017 zijn er conform de Wpg 393 patiënten met een STEC-infectie gemeld (Figuur 1). Van deze patiënten hadden 58 patiënten een bevestigde STEC O157-infectie en 114 een STEC non-O157-infectie. Van de overige patiënten kon het ingestuurde isolaat niet als STEC bevestigd worden (n=47) of was er geen isolaat ingestuurd (n=174). Iets meer vrouwen (59%) dan mannen hadden een STEC-infectie. HUS werd gemeld voor 12 patiënten, waarvan 4 kinderen (1-4 jaar) en 8 volwassenen (33-84 jaar), 67% was vrouw. Bij 5 HUS-patiënten was de O-typering bekend: 2x O157 (1 kind en 1 volwassene), O26 (kind), O183 (volwassene) en O niet-typeerbaar (volwassene). Twee volwassenen zijn overleden aan de STEC-infectie: een 81-jarige man en een 83-jarige vrouw, beiden met een niet-getypeerde STEC.
Figuur 1. Aantal STEC-infecties gemeld over de jaren 2007-2017, onderverdeeld naar STEC O157, non-O157, en O-typering niet bekend. Tot 2007 was alleen STEC O157 meldingsplichtig, in juli 2016 zijn de meldingscriteria aangescherpt
De meeste STEC O157-infecties werden in 2017 in de maanden juni tot en met augustus (60%) gezien. Minder sterk (41%) gold dit ook voor de STEC non-O157-infecties. De piek van de niet-getypeerde STEC-infecties lag meer in de maanden juli tot en met september (43%). De mediane leeftijd van de patiënten lag boven de 40 jaar (Tabel 1). De STEC O157-infecties waren gelijkmatig verdeeld over de leeftijden, terwijl STEC non-O157-infecties minder onder 30 tot 49 jarigen lijken voor te komen en de leeftijdspiek bij de niet-getypeerde STEC-infecties ligt bij de 60-plussers. Rond 95% van de patiënten werd gemeld met in ieder geval diarree. Bloed in de ontlasting en ziekenhuisopname werd vaker gemeld bij STEC O157-infecties dan bij de andere infecties, de overige symptomen werden ongeveer even vaak gemeld binnen de 3 groepen. In ongeveer 10% van de gevallen werd melding gemaakt van andere zieken in de omgeving van de patiënt, wat voornamelijk gezins-/huishoudcontacten waren.
Van de getypeerde STEC-infecties was 17-18% in het buitenland opgelopen (Tabel 1), bij de niet-getypeerde STEC-infecties was dit 28%. In Afrika werden met name STEC O157- en niet getypeerde infecties opgelopen, in Europa waren dat net iets vaker STEC non-O157-infecties.
Tabel 1. Kenmerken van STEC-infecties gemeld in 2017
| O157 | STEC non-O157 | Overig/niet getypeerd | |
| N | 58 | 114 | 221 |
| Mediane leeftijd (range) | 41,5 (2-89) | 40 (0-83) | 49 (1-95) |
| Geslacht - vrouw (%) | 37/58 (64) | 70/114 (61) | 126/221 (57) |
| Diarree (%) | 54/58 (93) | 107/113 (95 ) | 208/216 (96) |
| Bloed in ontlasting (%) | 45/58 (78) | 51/113 (45) | 89/216 (41) |
| Braken (%) | 11/58 (19) | 29/113 (26) | 58/216 (27) |
| Misselijk (%) | 21/58 (36) | 41/113 (36) | 78/216 (36) |
| Buikpijn (%) | 34/58 (59) | 61/113 (54) | 129/216 (60) |
| Buikkramp (%) | 31/58 (53) | 48/113 (42) | 82/216 (38) |
| Minder urineren (%) | 3/58 (5) | 3/113 (3) | 18/216 (8) |
| Koorts (%) | 11/58 (19) | 25/113 (22) | 61/216 (28) |
| Ziekenhuisopname (%) | 23/58 (40) | 24/112 (21) | 60/213 (28) |
| HUS (%) | 2/58 (3) | 3/113 (3) | 7/216 (3) |
| Overleden | 0 | 0 | 2 |
| Andere zieken in omgeving (%) | 4/52 (8) | 8/101 (8) | 18/189 (10) |
| eigen gezin/huishouden | 3 | 6 | 14 |
| overig | 1 | 2 | 4 |
| Buitenland (%) | 10/57 (18) | 19/109 (17) | 59/213 (28) |
| Afrika | 4 (40) | 6 (32) | 25 (42) |
| Azië | 2 (20) | 3 (16) | 14 (24) |
| Europa | 3 (30) | 8 (42) | 14 (24) |
| Overig | 1 (10) | 2 (11) | 6 (10) |
De extra vragen in Osiris hoeven alleen ingevuld te worden als de infectie in Nederland is opgelopen of als dat onbekend is. Bij 96%, 92% en 93% van respectievelijk de STEC O157-, STEC non-O157- en overige infecties die aan dit criterium voldoen werden 1 of meer van deze vragen ingevuld (Tabel 2). Vrijwel alle patiënten aten vlees (88-100%). Rauwe melk lijkt in 2017 vaker te zijn
gedronken door de groep STEC O157 patiënten (21%) dan door de andere 2 groepen (7%). Ook hadden de STEC O157-patiënten meer contact met huisdieren (72%) dan de andere 2 groepen (42-53%). Contact met landbouwhuisdieren (6-10%) en mest (5-15%) is minder gemeld. 13%, 20% en 32% van de respectievelijk STEC non-O157-, STEC O157- en overige patiënten gebruikte maagzuurremmers. Ook had 36% tot 56% van de patiënten onderliggend lijden.
Tabel 2. Voedselconsumptie, contact met dieren, medicijngebruik en onderliggend lijden gerapporteerd door STEC-patiënten die niet in buitenland zijn geweest, 2017
| O157 (%) | STEC non-O157 (%) | overig (%) | |
Gegevens beschikbaar | 45/47 (96) | 83/90 (92) | 143/154 (93) |
| Vleeseter | 40/40 (100) | 68/77 (88) | 120/133 (90) |
| biefstuk | 5/38 (13) | 15/68 (22) | 22/117 (19) |
| tartaar | 3/38 (8) | 7/68 (10) | 14/117 (12) |
| hamburger | 14/38 (37) | 18/68 (26) | 35/117 (30) |
| filet americain | 6/38 (16) | 8/68 (12) | 22/117 (19) |
| carpaccio | 5/38 (13) | 3/68 (4) | 6/117 (5) |
| rosbief | 2/38 (5) | 5/68 (7) | 13/117 (11) |
| ossenworst | 2/38 (5) | 2/68 (3) | 7/117 (6) |
| rauw.niet-gaar vlees | 13/38 (34) | 26/68 (38) | 46/117 (39) |
| Kiemgroenten | 5/39 (13) | 12/67 (18) | 13/116 (11) |
| Slasoorten | 30/39 (77) | 37/67 (55) | 68/116 (59) |
| Rauwe melk | 8/38 (21) | 5/67 (7) | 8/114 (7) |
| Rauwmelkse kaas | 4/38 (11) | 2/67 (3) | 7/114 (6) |
| Contact met dieren | 32/39 (82) | 35/72 (49) | 78/130 (60) |
| huisdieren | 28/39 (72) | 30/72 (42) | 68/129 (53) |
| landbouwhuisdieren | 4/39 (10) | 4/72 (6) | 11/129 (9) |
| Contact met mest | 6/41 (15) | 5/74 (7) | 6/132 (5) |
| Immunosuppresiva | 2/41 (5) | 3/78 (4) | 10/126 (8) |
| Maagzuurremmers | 8/41 (20) | 10/78 (13) | 40/126 (32) |
| Cholesterolverlagers | 5/41 (12) | 2/78 (3) | 11/126 (9) |
| Onderliggend lijden | 18/42 (43) | 27/75 (36) | 73/130 (56) |
Mogelijke bronnen van infectie
Naar aanleiding van een klacht en/of een vermoede voedselbron van infectie werden in 2017 in 6 gevallen voedselmonsters op STEC getest door de NVWA. In 1 van onderzochte monsters werd STEC aangetoond. Het was echter niet mogelijk om een match aan te tonen met de infectie, omdat er geen humaan isolaat beschikbaar was.
De NVWA onderzocht in 2017 in 23 monitoringsprojecten de aanwezigheid van STEC in voedsel, waarbij het zwaartepunt lag bij retailvleesprojecten. De hoogste prevalentie werd gevonden in vers vlees van kleine herkauwers: in 18 van de 196 monsters (9,2%) werd een STEC-isolaat gevonden (Tabel 3). Beperkte monitoring op retailleesbereidingsmonsters van kleine herkauwers (gehakt, gekruid, etc.) liet een nog hogere prevalentie zien, met 5 isolaten in 29 monsters (17,2%). In kalfsvlees was de prevalentie ook hoog: 16 isolaten werden gevonden in 236 monsters (6,8%). Interessant is dat in de monitoringsprojecten op visproducten, mosselen, oesters en levende tweekleppigen alleen in 1 monster levende tweekleppigen een isolaat gevonden werd. In de projecten met betrekking tot groenten en kruiden werden dit jaar enkel in rauw te consumeren groente 2 monsters positief bevonden.
Tabel 3. Aantal STEC-positieve en genomen monsters binnen NVWA-monitoringsprojecten, 2017
| positief/monsters | % | |
| vers vlees van kleine herkauwers | 18/196 | 9,2 |
| vleesbereidingsmonsters van kleine herkauwers | 5/29 | 17,2 |
| kalfsvlees | 16/236 | 6,8 |
| vlees voor rauwe consumptie | 4/281 | 1,4 |
| vers rundvlees | 6/273 | 2,2 |
| gehakt en vleesbereidingen | 3/265 | 1,1 |
| bewerkt pluimveevlees | 3/265 | 1,1 |
| vers pluimveevlees | 0/273 | 0 |
| import exotisch vlees | 2/46 | 4,3 |
| visproducten | 0/630 | 0 |
| mosselen | 0/63 | 0 |
| oesters | 0/28 | 0 |
| levende tweekleppigen | 1/229 | 0,4 |
Er werden in 2017 in voedsel in totaal 56 isolaten gevonden, met 31 verschillende O-groepen. Hierbij werd O146:H21 (n=8) het meest gevonden. Slecht 3 van deze isolaten waren positief voor het eae-gen, waaronder de 2 isolaten uit rauw te consumeren groente.
Naast de projecten gericht op voedsel werden ook mestmonsters (van vleeskalveren) onderzocht op aanwezigheid van STEC, waarbij STEC geïsoleerd werd bij 49 van de 196 geteste bedrijven (25,3%).
Er werden in totaal 54 specifieke isolaten verkregen. De serotypes O136:H12 (n=8) en O157:H7 (n=8) werden het meest gevonden. De O136:H12 isolaten waren allen eae-negatief, van de 8 O157:H7 isolaten waren 6 eae-positief.
Humane isolaten
Van 55 van de 58 STEC O157-patiënten was het isolaat beschikbaar, iets meer dan de helft bevatte beide stx-genen (53%), 46% bevatte alleen het stx2-gen en 1 isolaat (2%) bevatte alleen het stx1-gen (Tabel 4). Van de 107 beschikbare STEC non-O157-isolaten bevatten 42 (39%) isolaten alleen het stx1-gen, 47 (44%) isolaten alleen het stx2-gen en 18 (17%) isolaten bevatten beide genen. In totaal hadden de meeste isolaten (55%) het eae- en het EHEC-hly-gen. Binnen STEC non-O157 werd STEC O26 (n=33; 29%) het meest gevonden, op afstand gevolgd door STEC O103 (n=9; 8%) en STEC O146 (n=8; 7%). In totaal werden er 37 verschillende O-groepen gevonden, naast 7 niet-typeerbare en 3 auto-agglutinabele STEC’s. In de periode 2007-2017 waren O26 (n=211; 15%), O91 (n=140; 10%), O103 (n=102; 7%), O146 (n=100; 7%) en O63 (n=93; 7%), na O157 (n=760), de 5 meest gevonden O-groepen.
Tabel 4. Detectie van genen in de O157- en non-O157-isolaten, 2017
| O157 | non-O157 | |
| n | 55 | 107 |
| stx 1 | 1 (2%) | 42 (39%) |
| stx 2 | 25 (46%) | 47 (44%) |
| stx2f | 0 | 11 (10%) |
| stx1 en stx2 | 29 (54%) | 18 (17%) |
| eae | 0 | 13 (12%) |
| EHEC-hly | 0 | 15 (14%) |
| eae & EHEC-hly | 55 (100%) | 59 (55%) |
| geen van beide | 0 | 20 (19%) |
WGS-clusters
Bij alle beschikbare isolaten uit 2017 werd voor het eerst WGS gebruikt voor clusterdetectie. Binnen de STEC O157-isolaten werden 6 clusters gedetecteerd met 15 patiënten (2-3 patiënten per cluster). Bij 5 clusters lag er maximaal 16 dagen tussen eerste ziektedagen, bij het zesde cluster lagen er 2 maanden tussen, maar was er wel sprake van regionale clustering. Geografische clustering werd ook in 2 andere O157-clusters gezien. Verder valt op dat 5 van de 6 clusters uit alleen volwassenen bestaan. De vragenlijstgegevens leverden geen duidelijke bron voor de verschillende clusters op. Bij de 2 clusters van STEC O26 valt op dat bij het ene cluster de 3 betrokken volwassenen allemaal binnen 2 dagen van elkaar ziek waren geworden en dat zij alle 3 filet américain hadden gegeten. Bij het tweede cluster van 2 patiënten lagen er 24 dagen tussen de eerste ziektedagen met als enige overeenkomst het eten van biefstuk. De 2 clusters van STEC O146 (2-3 patiënten per cluster) hadden geen duidelijke link onderling en bij de 2 clusters van STEC O103 (2 patiënten per cluster) lagen de eerste ziektedagen 1 tot 2 maanden uit elkaar en was er 1 regionaal geclusterd. De enige link tussen de 2 patiënten met STEC O121 was een periode van maar 5 dagen tussen de eerste ziektedag. Het STEC O63-cluster tenslotte, was opvallend omdat hierin alle 7 patiënten met STEC O63 uit 2017 zaten. De tussenpozen tussen eerste ziektedag varieerde van 3 dagen tot 3 maanden, waarbij 4 patiënten uit dezelfde regio kwamen.
Discussie
2017 was het eerste volledige jaar na de invoering van de nieuwe meldingscriteria in juli 2016. Zoals verwacht door de aanscherping van de meldingscriteria, zette de daling van het aantal gemelde STEC-infecties door, met name het aantal meldingen van infecties zonder STEC-typering. De surveillance is nu beperkt tot de acute infecties. Die lenen zich het beste voor (preventieve) GGD-acties - advies en voorlichting - tegen verdere verspreiding. Deze acute infecties geven een beter beeld van eventuele verheffingen dan chronische en/of vage klachten waarbij een STEC wordt gevonden. De invoering van WGS voor alle STEC-isolaten is daarbij een extra, belangrijk, hulpmiddel voor het detecteren van clusters.
De typen STEC O26 en O103 werden, na STEC O157, het meest aangetroffen. Deze 3 O-typen geven een verhoogd risico op een ernstig verloop van de ziekte, inclusief HUS. (6-10) STEC O26 heeft, sinds STEC non-O157 is opgenomen in de surveillance in Nederland, elk jaar in de top 3 van meest voorkomende O-typen gestaan. Hoewel deze 2 non-O157 typen een belangrijk aandeel hebben, blijft STEC O157 veruit de belangrijkste, zowel in aantal als in ernst. Vooral bloed in de ontlasting en ziekenhuisopname worden vaker gezien bij STEC O157-infecties dan bij de andere infecties.
In voedsel- en mestmonsters werden voornamelijk O146:H21, O157:H7 en O136:H12 gevonden. STEC O157 bij mensen is tot nu toe in principe altijd H7 geweest (kan wel fenotypisch H- zijn, maar hier wordt niet (meer) op getest). Van de 8 patiënten met STEC O146-infecties waren er 5 O146:H21 en 3 O146:H28. In 2017 werd 1 infectie gemeld met een STEC O136, deze STEC droeg hetzelfde H-type als in de mestmonsters werd gevonden. Recent is een Nederlandse attributiestudie uitgevoerd met gegevens en isolaten van patiënten en runderen, schapen en geiten, varkens en pluimvee uit de surveillance van 2011 tot en met 2014. (2) Daaruit bleek dat ongeveer de helft van de infecties kan worden toegeschreven aan runderen als reservoir en de types O157, O26, O91 en O103 zelfs 61-75%. Ongeveer een kwart van de infecties kan worden toegeschreven aan schapen en geiten, en 71-77% van de infecties aan O146. Varkens en pluimvee zijn kleinere reservoirs van STEC.
Met de invoering van de nieuwe meldingscriteria is ook Osiris aangepast, waarbij de aparte, langere vragenlijst die voorheen werd afgenomen voor extra informatie over risicofactoren, is geïntegreerd en nieuwe vragen toegevoegd. Naar medicijngebruik en onderliggend lijden werd eerder niet in de aparte vragenlijst gevraagd. Vooral de patiënten met een infectie waarbij we het O-type niet weten, lijken vaker medicijnen te gebruiken en onderliggend lijden te hebben in vergelijking tot de respondenten in een controle-survey die sinds 2008 wordt uitgevoerd in de algemene bevolking. (11) In de periode 2008-2016, rapporteerde 13% (9-17% per jaar) en 2% (1-3% per jaar) van deze respondenten respectievelijk maagzuurremmers en immunosuppresiva te gebruiken en had 35% (30-40% per jaar) onderliggend lijden. Alleen het gebruik van cholesterolverlagers verschilt niet tussen STEC-patiënten en respondenten (16% (12-21%)).
De overstap van PFGE naar WGS voor clusterdetectie binnen de STEC O157-infecties heeft niet tot grote veranderingen geleid in de detectie van clusters. Het aantal clusters en de grootte van de clusters waren vergelijkbaar. Wel waren de WGS-resultaten sneller beschikbaar dan de PFGE-resultaten in de voorgaande jaren en konden de resultaten makkelijker met WGS-resultaten van andere instituten en landen vergeleken worden. PFGE werd niet toegepast op STEC non-O157 en ook voor deze groep was 2017 het eerste jaar waarover WGS-gegevens beschikbaar waren zodat ook voor STEC non-O157 clusterdetectie kon worden uitgevoerd. Sommige O-types clusterden sterk, bijvoorbeeld O63, terwijl anderen, bijvoorbeeld O26, een veel grotere spreiding lieten zien. Doordat historische data ontbreken is het, vooral bij lage aantallen isolaten, lastig te bepalen of het bij clustering binnen een O-type daadwerkelijk om een gezamenlijke bron gaat of om een stam die weinig evolueert. Een ander voordeel van WGS is dat hiermee ook het O- en H-type bepaald kan worden en groot aantal andere analyse in silico kan worden uitgevoerd (zoals additionele virulentiegenen en resistentiegenen). Momenteel wordt met de data van 2017 een validatie uitgevoerd van serologische en in silico serotypering en wordt binnenkort beslist of we volledig overgaan op in silico serotypering voor STEC waarbij de O- en H-typering in silico op basis van de WGS-resultaten wordt bepaald.
De focus van de STEC-surveillance ligt sinds juli 2016 op acute infecties. Door de invoering van de nieuwe meldingscriteria is het aantal meldingen gedaald, maar is de gemiddelde hoeveelheid (achtergrond)informatie over de patiënten gestegen. De focus op de meer voor de publieke gezondheid relevante infecties en meer informatie per gemelde patiënt, is een versterking van de surveillance. STEC O157 blijft de belangrijkste verwekker van STEC-infecties in Nederland, zowel in voorkomen als in ernst, gevolgd door STEC O26. In niet-humane isolaten werden voornamelijk STEC O146, O157 en O136 aangetroffen. De overstap naar WGS voor alle STEC-isolaten heeft de clusterdetectie binnen STEC O157 versneld en maakt het nu mogelijk om ook clusters binnen de STEC non-O157 tijdig te ontdekken.
Wij bedanken alle GGD'en en medisch microbiologische laboratoria hartelijk voor hun medewerking bij het verzamelen van de patiëntgegevens en het insturen van isolaten. Ook bedanken we de medewerkers van de NVWA voor het bemonsteren van en onderzoek naar landbouwhuisdieren en (verdacht) voedsel.
Auteurs
I.H.M. Friesema1, S. Kuiling1, M. van der Voort2, P.H. in ‘t Veld2, M.E.O.C. Heck1, E. Franz1
1. RIVM, Centrum Infectieziektebestrijding2. Nederlandse Voedsel- en Warenautoriteit (NVWA), Divisie Handhaving
Correspondentie
Literatuur
- Smith J.L., Fratamico P.M., Gunther N.W. Shiga Toxin-Producing Escherichia coli. Advances in applied microbiology 2014; 86: 145-97.
- Mughini-Gras L., van Pelt W., van der Voort M., Heck M., Friesema I., Franz E. Attribution of human infections with Shiga toxin-producing Escherichia coli (STEC) to livestock sources and identification of source-specific risk factors, The Netherlands (2010-2014). Zoonoses Public Health 2018; 65: e8-e22.
- Friesema I.H., Van De Kassteele J., De Jager C.M., Heuvelink A.E., Van Pelt W. Geographical association between livestock density and human Shiga toxin-producing Escherichia coli O157 infections. Epidemiol Infect 2011; 139: 1081-7.
- Friesema I.H.M., Kuiling S., van der Voort M., in 't Veld P.H., Heck M.E.O.C., Franz E. Surveillance van Shiga toxine-producerende Escherichia coli (STEC) in Nederland, 2016. Infectieziekte Bulletin 2017; 28: 228-35.
- Derzelle S., Grine A., Madic J., et al. A quantitative PCR assay for the detection and quantification of Shiga toxin-producing Escherichia coli (STEC) in minced beef and dairy products. International Journal of Food Microbiology 2011; 151: 44-51.
- Bruyand M., Mariani-Kurkdjian P., Gouali M., et al. Hemolytic uremic syndrome due to Shiga toxin-producing Escherichia coli infection. Medecine et maladies infectieuses 2018; 48: 167-74.
- Naseer U., Lobersli I., Hindrum M., Bruvik T., Brandal L.T. Virulence factors of Shiga toxin-producing Escherichia coli and the risk of developing haemolytic uraemic syndrome in Norway, 1992-2013. Eur J Clin Microbiol Infect Dis 2017; 36: 1613-20.
- Gould L.H., Mody R.K., Ong K.L., et al. Increased Recognition of Non-O157 Shiga Toxin-Producing Escherichia coli Infections in the United States During 2000-2010: Epidemiologic Features and Comparison with E. coli O157 Infections. Foodborne Pathog Dis 2013; 10: 453-60.
- Käppeli U., Hächler H., Giezendanner N., Beutin L., Stephan R. Human infections with non-O157 Shiga toxin-producing Escherichia coli, Switzerland, 2000-2009. Emerg Infect Dis 2011; 17: 180-5.
- Newell D.G., La Ragione R.M. Enterohaemorrhagic and other Shiga toxin-producing Escherichia coli (STEC): Where are we now regarding diagnostics and control strategies? Transbound Emerg Dis 2018: doi: 10.1111/tbed.12789.
- Friesema I.H.M., van Gageldonk-Lafeber A.B., Van Pelt W. Extension of traditional infectious disease surveillance with a repeated population survey Eur J Public Health 2015; 25: 130-4.
Infectieziekten Bulletin, Jaargang 29, editie 8 (oktober).