Inzicht in respiratoir syncytieel virus in jonge kinderen
Noodzakelijk voor toekomstige preventie
Het respiratoir syncytieel virus (RSV) is een belangrijke verwekker van luchtweginfecties bij mensen van alle leeftijden. Vooral jonge kinderen en ouderen kunnen ernstig ziek worden en eraan overlijden. Wereldwijd worden met name jonge kinderen met RSV-infectie in het ziekenhuis opgenomen. Ook in Nederland veroorzaakt RSV (ernstige) luchtweginfecties bij jonge kinderen, hoewel exacte informatie hierover ontbreekt. Mogelijk komt er op korte termijn een nieuwe langwerkende monoklonale antistof of maternale vaccinatie tegen RSV. Om te kunnen beoordelen of dit op grote schaal ingezet kan worden is er een beter inzicht nodig in de ziektelast van RSV bij jonge kinderen. Als een RSV-vaccin of een monoklonale antistof tegen RSV in het Rijksvaccinatieprogramma (RVP) opgenomen wordt, zal om de effecten ervan te kunnen meten, de surveillance van RSV verbeterd moeten worden. Zowel meer inzicht in de ziektelast van RSV als het verbeteren van RSV-surveillance zijn doelstellingen van het Europese RESCEU-project (REspiratory Syncytial virus Consortium EUrope), waaraan verschillende landen, waaronder Nederland, deelnemen. In dit artikel bespreken wij de epidemiologie van RSV-infecties in jonge kinderen wereldwijd en in Nederland. Verder bespreken wij mogelijke preventieve maatregelen, zoals vaccinatie tegen RSV of een verbeterd product met monoklonale antistoffen tegen RSV.
Vanaf de jaren ’50 van de vorige eeuw hebben vaccinatieprogramma’s voor kinderen wereldwijd gezorgd voor vermindering van ziektelast en sterfte.(1) Kinderen worden op jonge leeftijd gevaccineerd om hen vroeg in het leven te beschermen tegen infectieziekten. Zuigelingen kunnen direct na de geboorte beschermd worden tegen infectieziekten met een ernstig beloop, door hun moeders tijdens de zwangerschap te vaccineren (maternale vaccinatie). Maternale vaccinatie tegen bepaalde infectieziekten wordt al sinds de jaren ’80 toegepast. In landen met een laag en gemiddeld inkomen worden zwangere vrouwen bijvoorbeeld op grote schaal gevaccineerd tegen tetanus.(2) Wereldwijd daalde hierdoor het aantal sterfgevallen door neonatale tetanus van 787.000 in 1988 naar 49.000 in 2013. Tijdens de influenza A(H1N1)-pandemie in 2009 kregen ook in landen met een gemiddeld hoog inkomen gezonde zwangere vrouwen het advies om zich te laten vaccineren. Sinds een aantal jaren krijgen zwangere vrouwen in deze landen toenemend maternale vaccinaties tegen seizoensgriep en kinkhoest aangeboden.(3) De effectiviteit en veiligheid van deze vaccinaties zijn goed.(4, 5)
Momenteel zijn er veel vaccins in ontwikkeling, die bescherming kunnen bieden tegen groep B-streptokokken (GBS) en RSV.(6) Hieronder zijn ook maternale vaccins.
RSV-infectie
RSV behoort tot de Pneumoviridae en is op basis van antigene verschillen in het oppervlakte-glycoproteïne G, onderverdeeld in RSV-A en RSV-B. RSV veroorzaakt luchtweginfecties die in ernst variëren van milde verkoudheidsverschijnselen tot bronchiolitis en pneumonie.(9) RSV is een veel voorkomende oorzaak van luchtweginfecties en sterfte bij ouderen. (7, 8) Kinderen jonger dan zes maanden worden het meest frequent ernstig ziek door RSV-infectie. Dit geldt in het bijzonder voor pasgeboren baby’s met onderliggend lijden en te vroeg geboren baby’s. Zeer recent zijn de eerste resultaten bekend gemaakt van een onderzoek naar de effectiviteit van een van de maternale kandidaatvaccins om jonge baby’s te beschermen tegen RSV-infectie.(10)
Epidemiologie van RSV in jonge kinderen wereldwijd
Wereldwijd overlijden veel kinderen jonger dan 5 jaar aan een acute lage luchtweginfectie. Een van de meest voorkomende oorzaken is infectie met RSV. (11, 12) In 2015 waren er naar schatting wereldwijd 33,1 miljoen episodes van acute lage luchtweginfectie in kinderen jonger dan 5 jaar, met 3,2 miljoen ziekenhuisopnames tot gevolg. Jaarlijks overlijden, vooral in landen met een laag en gemiddeld inkomen, ongeveer 120.000 kinderen door een RSV-infectie, de meeste zijn jonger dan zes maanden. (11,12)
Kinderen die overlijden door een RSV-infectie hebben vaak ernstige aangeboren aandoeningen aan bijvoorbeeld het hart. Ook te vroeg geboren baby’s hebben een grotere kans om te overlijden door RSV-infectie. De meeste kinderen die overlijden door een RSV-infectie bereiken het ziekenhuis niet en overlijden als gevolg van beperkte toegang tot medische zorg of door slechte medische zorg. (11) Ter illustratie: in Kenya is de ziektelast door RSV-infectie bij 759 kinderen van 0-12 jaar in kaart gebracht. In dat land zijn longontstekingen de belangrijkste doodsoorzaak onder kinderen.(13) 4,8% van de kinderen die in hun eerste levensjaar werden opgenomen in het ziekenhuis, had een longontsteking. In het RSV-seizoen werd meer dan 50% van de ernstige longontstekingen veroorzaakt door RSV. Buiten het RSV-seizoen was dit percentage minder dan 5%. In vergelijking met andere verwekkers van luchtweginfecties, zoals coronavirus, adenovirus of humaan metapneumovirus, verliepen RSV-infecties ook ernstiger. De hoogste incidentie werd gezien in het eerste levensjaar (2% per kind per jaar).(13)
Epidemiologie van RSV in jonge kinderen in Nederland
RSV komt ook in Nederland veel voor, vooral in het najaar en de winter (november t/m maart). Bijna alle kinderen zijn voor hun tweede jaar in contact met het virus geweest. Dit bleek uit een Nederlandse cohortstudie in 2003-2005 en in 2006-2007, waarin 2133 kinderen in hun eerste levensjaar maandelijks op RSV werden gescreend:• Bij 417 kinderen (20%) werd op enig moment een monster afgenomen voor PCR-onderzoek. De testuitslag van 84 kinderen (20%) was positief voor RSV. (14)• Bij 52 van de 84 kinderen was het monster afgenomen omdat zij symptomen hadden van een RSV-infectie. De overige 32 waren gevonden op basis van de maandelijkse screening.• Verder werden 18 van alle 2133 kinderen (0.84%) in het ziekenhuis opgenomen met een bewezen RSV-infectie.(14)Het komt in Nederland zelden voor dat een kind overlijdt door een RSV-infectie. In dat geval is er vrijwel altijd sprake van onderliggend lijden (persoonlijke communicatie Louis Bont).
Surveillance
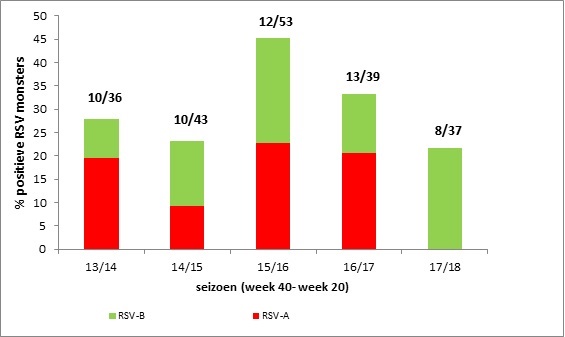
De surveillance van RSV in Nederland is op dit moment grotendeels onderdeel van de influenzasurveillance. Dit betekent dat de neus-keelslijmvliesmonsters, die in het kader van de influenzasurveillance wekelijks worden afgenomen door huisartsen van de Nivelpeilstations bij patiënten met een influenza-achtig ziektebeeld (IAZ) of een andere acute luchtweginfectie (ARI), ook worden getest op RSV. (15) In de afgelopen 5 respiratoire seizoenen (jaarlijks van begin oktober tot half mei) werd bij gemiddeld 30% (range 22%-45%) van de kinderen <1 jaar die naar de huisarts gingen vanwege een IAZ of ARI RSV-A of B aangetoond. (Figuur 1). (15)
Figuur 1. Percentage RSV-positieve keel- en neusmonsters bij kinderen <1 jaar die met acute respiratoire klachten bij de huisarts komen van week 40 – week 20 van het volgende jaar tijdens de seizoenen 2013/2014 t/m 2017/2018. De getallen boven de balken representeren het totaal aantal RSV positieve monsters/totaal aantal geteste monsters.
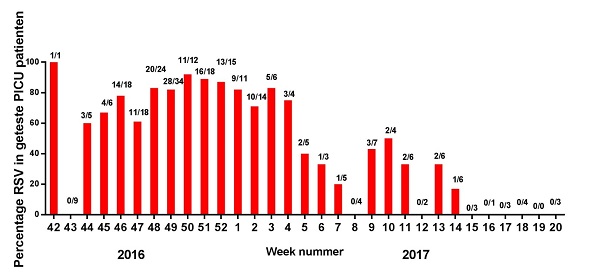
In de periode 2006-2016 nam het aantal kinderen met virale bronchiolitis op de intensive care van het ziekenhuis toe van 212 in 2006 tot 452 in 2016. (16) Bij de meesten kon de ziekteverwekker niet worden aangetoond. (14) Om meer inzicht te krijgen in de oorzaak van ernstige luchtweginfecties deed het RIVM onderzoek in de periode 2016-2017. In samenwerking met 6 pediatrische intensive care afdelingen werd bijgehouden hoeveel kinderen werden opgenomen met respiratoire klachten en wat de uitslagen van de laboratoriumonderzoeken waren (figuur 2). (17)
Figuur 2. Percentage testuitslagen op de pediatrische intensive care, dat positief was voor RSV, van week 42 2016 t/m week 20 2017. De getallen boven de balken representeren het totaal aantal RSV-positieve monsters/totaal aantal geteste monsters.
• De meeste kinderen (80%) waren <1 jaar;• Bij 79% van alle kinderen werd een laboratoriumtest aangevraagd;• waarvan bij 68% RSV werd aangetoond;• Omdat sommige kinderen ook co-infecties hadden was het niet altijd mogelijk om RSV als de ziekteverwekker vast te stellen;• Tijdens het hoogtepunt van het RSV-seizoen (half november 2016 tot half januari 217) was 80% van de kinderen die getest werden, positief voor RSV.
Preventie van RSV-infecties bij jonge kinderen door vaccinatie en immuunglobulinen; stand van zaken
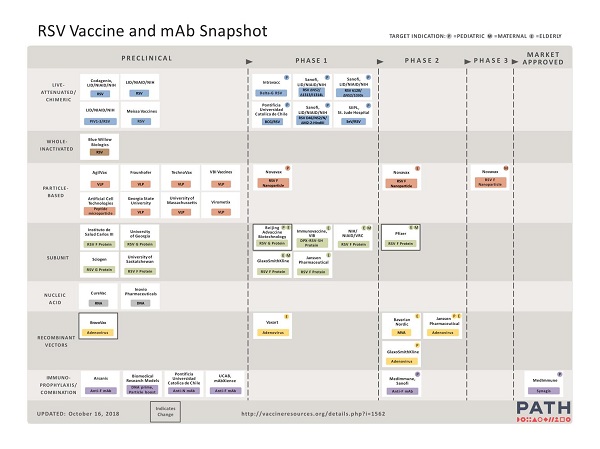
Al in de jaren ’60 heeft men geprobeerd om een levend verzwakt RSV-vaccin op de markt te brengen.(18) Dit was niet succesvol omdat in de klinische pre-registratieonderzoeken de gevaccineerde kinderen juist een verergering van de verschijnselen van een RSV-infectie kregen en hieraan soms zelfs overleden.(19) In de laatste 60 jaar zijn slechts 2 producten (RSV-intraveneus immuunglobuline (IVIG) en het monoklonaal palivizumab) goedgekeurd als preventie tegen RSV. Wel is de laatste jaren het aantal kandidaatvaccins en nieuwe monoklonale antistoffen gericht tegen RSV dat getest wordt in klinische pre-registratie onderzoeken, enorm toegenomen (figuur 3). (9) Veel kandidaatvaccins zijn gebaseerd op het fusie-F-eiwit. Dit eiwit zorgt voor de fusie van het virusmembraan met het gastheercelmembraan, waarbij het eiwit ook van confirmatie verandert van pre-fusie-F in post-fusie-F. Antistoffen tegen het F-eiwit, maar vooral tegen de epitopen die specifiek voorkomen op de conformatie van pre-fusie-F, zijn neutraliserend. Door stabilisatie van het pre-fusie-F-eiwit in vaccins, beschermen de antistoffen tegen deze vorm van het F-eiwit tegen RSV. (9)
Figuur 3. Overzicht van de ontwikkelingen in vaccins en immunoglobulinen tegen respiratoir syncytieel virus (https://vaccineresources.org/details.php?i=1562)
Momenteel worden wereldwijd 19 kandidaat-RSV-vaccins en producten die monoklonale antilichamen bevatten, klinisch getest. Het onderzoek van 47 kandidaatvaccins bevindt zich in de pre-klinische fase (figuur 3). (9) Vier van de kandidaatvaccins die klinisch getest worden zijn maternale vaccins. Van één van deze maternale vaccins zijn recent de voorlopige onderzoeksresultaten bekend gemaakt.(10) Het vaccin bestaat uit RSV-F-nanopartikels. De primaire uitkomstmaat was de klinische effectiviteit tegen lage luchtweginfecties, veroorzaakt door RSV bij baby’s tot de leeftijd van drie maanden. De effectiviteit voor deze uitkomstmaat is geschat op 39,4% (97,5% betrouwbaarheidsinterval (BI) -1,0% - +63,7%). Dit is niet statistisch significant, waardoor het primaire eindpunt niet gerealiseerd is. In dit onderzoek werd de effectiviteit tegen ziekenhuisopnames vanwege RSV geschat op 44,4% (95%BI 19,6%-61,5%) en tegen ernstig zuurstoftekort door RSV op 48,3% (95%BI -8,2% - +75,3%).
Er zijn grote verschillen in uitkomsten tussen de landen, die mee hebben gedaan aan het onderzoek. Deze verschillen worden onder meer veroorzaakt door het feit dat de vaccinatie niet overal op hetzelfde moment tijdens de zwangerschap gegeven werd. De fabrikant gaat in overleg met de Amerikaanse en Europese registratie autoriteiten of registratie op basis van deze gegevens haalbaar is.
Er is momenteel 1 monoklonale antistof (palivizumab, Synagis®) tegen het F-eiwit van RSV beschikbaar. Palivizumab is gericht tegen een epitoop dat zowel op het pre-fusie-F als het post-fusie-F voorkomt. In Nederland wordt palivizumab vanwege de hoge kosten alleen toegediend aan baby’s die een verhoogd risico hebben op een ernstige RSV-infectie omdat zij te vroeg geboren zijn of hart-long-aandoeningen hebben. (21) Tijdens het RSV-seizoen moeten zij maandelijks palivizumab toegediend krijgen. Een kinderarts stelt hiervoor de indicatie. Omdat slechts een klein deel van baby’s met ernstige RSV-infectie behoort tot de risicogroep, is de impact van palivizumab op de totale RSV-ziektelast beperkt. Een andere monoklonale antistof (MEDI8897 ofwel nirsevimab) is momenteel in een fase 2-pre-registratieonderzoek. Nirsevimab heeft een 3keer langere halfwaardetijd en een 9-voudige neutraliserende activiteit in vergelijking met palivizumab. (18, 22) Nirsevimab is specifiek gericht tegen pre-fusie-F. De fabrikant van nirsevimab geeft aan dat de prijs kan concurreren met toekomstige RSV-vaccins. De lange halfwaardetijd kan er toe leiden dat het mogelijk is om alle kinderen in hun eerste RSV-seizoen hiermee te beschermen tegen RSV.
Discussie
Infecties die worden veroorzaakt door RSV komen veel voor. Vooral voor kinderen jonger dan 5 jaar is de ziektelast groot. Waarschijnlijk worden wereldwijd vooral kinderen jonger dan 6 maanden oud opgenomen in het ziekenhuis. (11) 99% van de kinderen die overlijden door een RSV-infectie - zowel in als buiten het ziekenhuis - wonen in landen met een laag en gemiddeld inkomen. Dit komt vooral door de beperkte toegang tot medische zorg en door slechte medische zorg.(11)
Ook in Nederland komen RSV-infecties bij jonge kinderen veel voor, soms met een ernstig beloop. Veel kinderen krijgen in de winter lageluchtweginfecties, veroorzaakt door RSV.(15) Exacte cijfers hierover zijn moeilijk te verkrijgen, omdat in ziekenhuizen niet routinematig wordt getest op RSV. In de huisartsensurveillance, via de Nivelpeilstations, is het percentage deelnemende jonge kinderen tot nu toe beperkt. Dit zal de komende jaren hopelijk verbeteren (i.e. toenemen) door de afspraak om minstens 2 patiënten die als eerste in een week gezien worden met een ILI of ARI te bemonsteren, waaronder bij voorkeur een kind jonger dan 10 jaar. (15)
Het inzicht in RSV-gerelateerde ernstige lagere luchtweginfecties is beperkt. Deze aandoeningen zijn moeilijk te surveilleren, terwijl preventieve maatregelen juist tot doel hebben de incidentie van deze ernstige uitingen van ziekte te verlagen. Dit is in meerdere Europese landen het geval.(15) Wanneer een maternaal RSV-vaccin of nieuwe monoklonale antistof beschikbaar komt, is beter inzicht in de ziektelast van RSV onder jonge kinderen noodzakelijk om een afweging over grootschalige toepassing, bij voorbeeld in het Rijksvaccinatieprogramma (RVP) te ondersteunen.(23)Om continuïteit van de surveillance te bevorderen, dient de extra werklast, die deze surveillance geeft, zo minimaal mogelijk te zijn.In 2017 startte het RESCEU-project waaraan een aantal landen in Europa, waaronder Nederland deelneemt. Het doel van dit project is het verkrijgen van meer inzicht in de ziektelast van RSV in Europa.Hiervoor worden de surveillancedata verzameld van alle patiënten - van alle leeftijden - met een RSV-infectie. In Nederland gebeurt dit door middel van het direct en modelmatig combineren van patiëntgegevens uit ziekenhuizen en van huisartsen, perinatale gegevens en uitslagen van laboratoriumonderzoek. Verder wordt beoogd de surveillance van RSV te verbeteren, zowel op nationaal, als op Europees niveau. Hierbij werken de verschillende instituten voor publieke gezondheid en universiteiten van de deelnemende landen samen met het European Centre for Disease Prevention and Control (ECDC).
Op dit moment zijn er 2 preventieve toepassingen in de laatste onderzoeksfase voor eventuele toelating tot de markt. De registratie van geneesmiddelen in Europa wordt beoordeeld door het EMA (European Medicines Agency). De resultaten van onderzoek naar de effectiviteit en de veiligheid van beide middelen zijn cruciaal om te kunnen bepalen of 1 van beide mogelijk de voorkeur verdient en op welke manier ze worden aangeboden, bijvoorbeeld via het RVP. Ook de hoogte van de ziektelast per risicogroep speelt hierbij een belangrijke rol. Op dit moment komen immers alleen kinderen met een onderliggende aandoening in aanmerking voor behandeling met een de monoklonale antistof palivizumab. Dit wordt bekostigd via de zorgverzekering.(21) Een dergelijk risicogroepenbeleid kan ingebed worden in het RVP, maar mogelijk is de ziektelast van RSV zo hoog, dat het beter is om alle kinderen te beschermen tegen RSV met vaccinatie of monoklonale antistoffen. Deze afweging kan worden onderzocht in kosten-effectiviteitsstudies.
De conclusie van dit onderzoek is dat de ziektelast van RSV-infecties bij jonge kinderen wereldwijd - maar voornamelijk in landen met een laag en gemiddeld inkomen - hoog is. De sterfte aan RSV-infecties wordt grotendeels veroorzaakt door gebrek aan medische zorg. In Nederland komen (ernstige) luchtweginfecties bij jonge kinderen ook vaak voor. Het exacte aandeel van RSV hierin is niet goed bekend, maar aanzienlijk. De vooruitzichten op veilige en effectieve preventie door gebruik van monoklonale antistoffen en maternale vaccinatie, zijn goed. Om het belang van deze preventieve maatregelen voor de publieke gezondheid goed te kunnen beoordelen, is meer inzicht in RSV-infecties nodig. Hiervoor is verbeterde surveillance van RSV-infecties van groot belang, waarbij systematische klinische en virologische dataverzameling van kinderen, zowel bij de huisarts als in het ziekenhuis zeer relevant zou zijn.
We bedanken de volgende personen voor hun deelname aan de SARI PICU surveillance:Amsterdam UMC locatie AMC - Emma Kinderziekenhuis: Job van Woensel, Marjorie de NeefAmsterdam UMC, locatie VUmc: Dick MarkhorstErasmus MC – Sophia Kinderziekenhuis: Dick Tibboel, Marjan de Jong, Els RoodbolLeids Universitair Medisch Centrum: Carole BrouwerMaastricht UMC+: Gijs VosUMC Utrecht: Wilhelmina Kinderziekenhuis: Brigitte Timmers-Raaijmaakers
We bedanken de huisartsen en patiënten die meegewerkt hebben aan de Nivel peilstation surveillance.
AT, GB, AM en NvdM (RIVM) zijn lid van het Respiratory Syncytial Virus Consortium EUrope (RESCEU). RESCEU heeft een beurs ontvangen van het Innovative Medicines Initiative 2 Joint Undertaking onder grant agreement 116019. Deze Joint Undertaking ontvangt support van het European Union's Horizon 2020 research and innovation programme en de European Federation of Pharmaceutical Industries and Associations. Nivel (GD) is associate partner in RESCEU.
We bedanken Hester de Melker, Louis Bont, Wim van der Hoek en Lieke Sanders voor hun bijdrage aan dit manuscript.
Auteurs
A. Teirlinck (1), D. Scheepmaker (2), G. Berbers (1), A. Meijer (1), G. Donker (3), N. van der Maas (1)
1. Centrum Infectieziektebestrijding, RIVM, Bilthoven
2. Wilhelmina kinderziekenhuis, UMC Utrecht
3. NIVEL Zorgregistraties eerste lijn
Correspondentie
Literatuur
- van Wijhe M, McDonald SA, de Melker HE, Postma MJ, Wallinga J. Effect of vaccination programmes on mortality burden among children and young adults in the Netherlands during the 20th century: a historical analysis. Lancet Infect Dis. 2016.
- Roper MH, Vandelaer JH, Gasse FL. Maternal and neonatal tetanus. Lancet. 2007;370(9603):1947-59.
- Abu Raya B, Edwards KM, Scheifele DW, Halperin SA. Pertussis and influenza immunisation during pregnancy: a landscape review. The Lancet Infectious Diseases. 2017;17(7):e209-e22.
- Campbell H, Gupta S, Dolan GP, Kapadia SJ, Kumar Singh A, Andrews N, et al. Review of vaccination in pregnancy to prevent pertussis in early infancy. J Med Microbiol. 2018;67(10):1426-56.
- Mosby LG, Rasmussen SA, Jamieson DJ. 2009 pandemic influenza A (H1N1) in pregnancy: a systematic review of the literature. Am J Obstet Gynecol. 2011;205(1):10-8.
- Sobanjo-Ter Meulen A, Duclos P, McIntyre P, Lewis KD, Van Damme P, O'Brien KL, et al. Assessing the Evidence for Maternal Pertussis Immunization: A Report From the Bill & Melinda Gates Foundation Symposium on Pertussis Infant Disease Burden in Low- and Lower-Middle-Income Countries. Clin Infect Dis. 2016;63(suppl 4):S123-S33.
- Falsey AR, Hennessey PA, Formica MA, Cox C, Walsh EE. Respiratory syncytial virus infection in elderly and high-risk adults. N Engl J Med. 2005;352(17):1749-59.
- van Asten L, van den Wijngaard C, van Pelt W, van de Kassteele J, Meijer A, van der Hoek W, et al. Mortality attributable to 9 common infections: significant effect of influenza A, respiratory syncytial virus, influenza B, norovirus, and parainfluenza in elderly persons. J Infect Dis. 2012;206(5):628-39.
- Griffiths C, Drews SJ, Marchant DJ. Respiratory Syncytial Virus: Infection, Detection, and New Options for Prevention and Treatment. Clin Microbiol Rev. 2017;30(1):277-319.
- Novavax. Prepare-tm Trial Topline Results 2019 [Available from: https://novavax.com/presentation.show.
- Shi T, McAllister DA, O'Brien KL, Simoes EAF, Madhi SA, Gessner BD, et al. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in young children in 2015: a systematic review and modelling study. Lancet. 2017.
- Scheltema NM, Gentile A, Lucion F, Nokes DJ, Munywoki PK, Madhi SA, et al. Global respiratory syncytial virus-associated mortality in young children (RSV GOLD): a retrospective case series. Lancet Glob Health. 2017;5(10):e984-e91.
- Berkley JA, Munywoki P, Ngama M, Kazungu S, Abwao J, Bett A, et al. Viral etiology of severe pneumonia among Kenyan infants and children. JAMA. 2010;303(20):2051-7.
- Zomer-Kooijker K, Uiterwaal CS, van der Gugten AC, Wilbrink B, Bont LJ, van der Ent CK. Decreased lung function precedes severe respiratory syncytial virus infection and post-respiratory syncytial virus wheeze in term infants. Eur Respir J. 2014;44(3):666-74.
- Reukers DFM, Van Asten L, Brandsema P, Dijkstra F, Donker G, van Gageldonk-Lafeber AB, et al. surveillance of influenza and other respiratory infections in the Netherlands: winter 2017/2018. Bilthoven: National Institute for Public Health and the Environment; 2018.
- Linssen RS, van Woensel JB, Bont L. High-Flow Oxygen Therapy in Infants with Bronchiolitis. N Engl J Med. 2018;378(25):2445-6.
- Teirlinck AC, Van Asten L, Brandsema P, Dijkstra F, Donker G, Van Gageldonk-Lafeber AB, et al. Surveillance of influenza and other respiratory infections in the Netherlands: winter 2016/2017. bilthoven: National Institute for Public Health and the Environment; 2017. Report No.: 2017-0096.
- Mazur NI, Higgins D, Nunes MC, Melero JA, Langedijk AC, Horsley N, et al. The respiratory syncytial virus vaccine landscape: lessons from the graveyard and promising candidates. Lancet Infect Dis. 2018.
- Kim HW, Canchola JG, Brandt CD, Pyles G, Chanock RM, Jensen K, et al. Respiratory syncytial virus disease in infants despite prior administration of antigenic inactivated vaccine. Am J Epidemiol. 1969;89(4):422-34.
- Jounai N, Yoshioka M, Tozuka M, Inoue K, Oka T, Miyaji K, et al. Age-Specific Profiles of Antibody Responses against Respiratory Syncytial Virus Infection. EBioMedicine. 2017;16:124-35.
- Moonen J. richtlijn RSV-infectie Bilthoven: RIVM; 2012 [Available from: https://lci.rivm.nl/richtlijnen/rsv-infectie.
- Zhu Q, McLellan JS, Kallewaard NL, Ulbrandt ND, Palaszynski S, Zhang J, et al. A highly potent extended half-life antibody as a potential RSV vaccine surrogate for all infants. Sci Transl Med. 2017;9(388).
- Gezondheidsraad. de toekomst van het rijksvaccinatieprogramma; naar een programma voor alle leeftijden. Den Haag: Gezondheidsraad; 2007.
Infectieziekten Bulletin, jaargang 30, themanummer Vaccinaties, nummer 3, april 2019