Surveillance van STEC in Nederland, 2018

In 1999 startte de surveillance van shigatoxineproducerende Escherichia coli (STEC) in Nederland met de meldingen van STEC O157-infecties. In 2007 zijn STEC non-O157-infecties hieraan toegevoegd. Per juli 2016 is de focus van de STEC-surveillance verschoven naar acute en ernstige(re) infecties middels nieuwe meldingscriteria. In 2018 werden 488 patiënten met een STEC-infectie gemeld, waarvan 59 patiënten met een STEC O157-infectie, 87 met een STEC non-O157-infectie, waaronder 23 STEC O26, en 342 patiënten met STEC zonder verdere typering. 21 patiënten werden gemeld met hemolytisch-uremisch syndroom (HUS) (5x O157, 6x O26, 10x zonder informatie over O-typering). STEC O157 blijft daarmee het belangrijkste serotype in Nederland, gevolgd door STEC O26. Voor het vaststellen van mogelijke bronnen van infectie onderzoekt de Nederlandse Voedsel- en Warenautoriteit (NVWA) monsters van voedsel en landbouwhuisdieren op STEC. In de niet-humane isolaten werden voornamelijk STEC O146, O113, O38 en O91 aangetroffen. Door de overstap naar het gebruik van whole genome sequencing (WGS) voor alle STEC-isolaten, is de clusterdetectie versneld en verbeterd. Er werden in 2018 meerdere WGS-clusters van patiëntisolaten gezien, maar geen met zowel humane als voedselisolaten. Met de invoering van de nieuwe meldingscriteria is het aantal meldingen gedaald, maar stijgt het aandeel meldingen zonder isolaat. Dit vormt een bedreiging voor de surveillance, omdat het opsporen van een cluster zeer afhankelijk is van de beschikbaarheid van een STEC-typering, en de bevestiging van een cluster met WGS wordt gedaan.
STEC is een bacterie die maag-darmklachten kan veroorzaken. De symptomen variëren van diarree tot hemorragische colitis en HUS. (1) STEC is een zoönose waarvan herkauwers, met name runderen, het belangrijkste reservoir zijn. (2) STEC-infecties zijn vaak het gevolg van de consumptie van besmet voedsel, maar transmissie via het milieu lijkt ook belangrijk. (2, 3) Acute STEC-infecties zijn meldingsplichtig volgens de Wet publieke gezondheid (Wpg), vanwege de ernst van de ziekte - vooral bij kleine kinderen en ouderen - en het risico op grootschalige uitbraken. In dit artikel presenteren we de resultaten van de surveillance voor het jaar 2018.
Methoden
Sinds juli 2016 gelden nieuwe meldingscriteria voor STEC. Bij diagnostiek met polymerase chain reaction (PCR) waarbij het laboratorium onderscheid kan maken naar shigatoxinegenen (stx1- en stx2-genen) en kan testen op escV of E. coli attaching-and-effacing gen (eae-gen), hoeven patiënten bij wie het stx1-gen wordt aangetoond alleen nog gemeld te worden als ook het escV- of eae-gen aanwezig is. Dit geldt niet bij het aantonen van het stx2-gen. In geval van kweekonderzoek gelden geen extra criteria. Verder is de meldingsplicht sinds juli 2016 beperkt tot de acute infecties (maximaal 21 dagen tussen eerste ziektedag en afnamedatum) waarbij de patiënten minimaal last hebben van diarree, braken en/of bloed in de ontlasting. De meldingscriteria in het geval van STEC-HUS zijn niet gewijzigd in 2016. Met de invoering van de nieuwe meldingscriteria is ook Osiris aangepast. De voorheen losse vragenlijst voor extra informatie over risicofactoren is geïntegreerd in het meldingssysteem Osiris, en enkele nieuwe vragen zijn toegevoegd. Deze vragenlijst wordt alleen zichtbaar als de infectie in Nederland is opgelopen of als dit onbekend is.
De laboratoria kunnen STEC-positieve E. coli-kolonies die voldoen aan de meldingscriteria opsturen naar het RIVM. Op het RIVM worden alle ingestuurde STEC-isolaten met PCR getest op de aanwezigheid van de belangrijkste virulentiegenen (stx-genen, eae-gen en het EHEC-hemolysinegen (EHEC-hly-gen)). Als deze virulentiegenen aangetoond worden, wordt het isolaat geanalyseerd met WGS. De WGS-gegevens worden vervolgens gebruikt voor in silico serotypering en clusterdetectie met core-genome multi-locus sequence typing (cgMLST). De cgMLST-clusterdetectie vervangt de PFGE-analyse, die sinds 2017 niet meer wordt uitgevoerd.
De resultaten van de surveillance over 2018 worden gerapporteerd met een onderverdeling naar STEC O157, STEC non-O157 en niet-getypeerde infecties. De groep niet-getypeerde infecties bestaat uit isolaten waarin het RIVM geen STEC kon aantonen en meldingen van patiënten van wie geen isolaat is ingestuurd. De in Osiris gemelde risicofactoren zijn, voor zover mogelijk, vergeleken met de antwoorden van 367 mensen die in 2018 mee hebben gedaan aan de controlesurvey. (4) Met behulp van logistische regressie, gecorrigeerd voor leeftijd en geslacht, werden odds ratio’s (OR) en bijbehorende 95% betrouwbaarheidsintervallen (95% BI) bepaald.
Als de bron van een infectie vermoedelijk het eten van besmette levensmiddelen is of het gevolg van contact met landbouwhuisdieren, neemt de GGD of het RIVM contact op met de NVWA voor monsteronderzoek naar STEC en typering van eventuele isolaten. Daarnaast doet de NVWA jaarlijks in verschillende monitoringsprojecten onderzoek naar producten op de aanwezigheid van STEC, test gevonden stammen op stx-genen en aanhechtingsgenen (eae, aggR+aaiC) en bepaalt het serotype. De methoden bij het onderzoek van de NVWA zijn gebaseerd op ISO-methode 13136 en de diverse typerings PCRs van het EURL-VTEC. De methode voor het aantonen van stx2f is gebaseerd op Derzelle et al. (5) Ook van de voedselisolaten zijn WGS-gegevens (cgMLST) beschikbaar, zodat een vergelijking met de patiëntisolaten gemaakt kan worden.
Resultaten
Patiënten
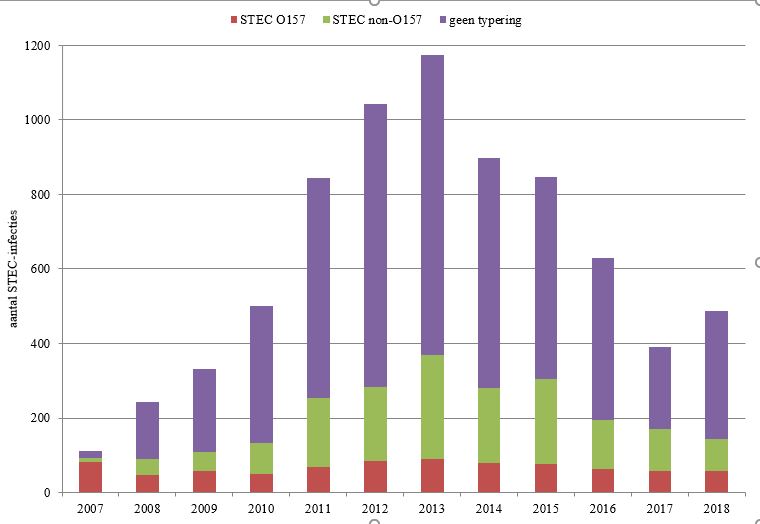
In 2018 werden 488 patiënten met een STEC-infectie gemeld via de meldingsplicht (figuur 1).
- Van deze patiënten hadden 59 een bevestigde STEC O157-infectie en 87 een STEC non-O157-infectie. In de isolaten van de overige patiënten kon geen STEC worden aangetoond (n=30) ofwel was er geen isolaat ingestuurd (n=312).
- Iets meer vrouwen (58%) dan mannen hadden een STEC-infectie. 21 patiënten kregen HUS: 7 jonge kinderen (1-5 jaar), 4 tieners (11-16 jaar) en 10 volwassenen (20-77 jaar), 62% was vrouw. Bij 11 HUS-patiënten was de O-typering bekend: 5x O157 (1 kind, 1 tiener en 3 volwassenen) en 6x O26 (5 kinderen en 1 volwassene). Er zijn geen overlijdens gemeld in 2018.
Figuur 1. Aantal STEC-infecties gemeld over de jaren 2007-2018 onderverdeeld naar STEC O157, non-O157, en O-typering niet bekend. Tot 2007 was alleen STEC O157 meldingsplichtig, in juli 2016 zijn de meldingscriteria aangescherpt.
Figuur 2. Leeftijdsverdeling (jaren) binnen de STEC-infecties in 2018 onderverdeeld naar STEC O157, non-O157, en O-typering niet bekend
- De meeste STEC O157-infecties werden in 2018 in de maanden juni tot en met augustus (56%) gezien. Minder sterk (43%) gold dit ook voor de STEC non-O157-infecties, de piek was bij deze infecties verspreid over meer maanden, namelijk van april tot en met augustus (69%). De piek van de niet-getypeerde STEC-infecties lag meer in de maanden juli tot en met september (42%).
- De mediane leeftijd van de patiënten varieerde van 23 jaar (O157) en 30 jaar (non-O157) tot 45,5 jaar (overig) (tabel 1). Onder de patiënten met O157-infecties vormden kinderen en jongeren van 10-19 jaar de grootste groep (24%). 25% van de patiënten met een non-O157-infectie was jonger dan 5 jaar en 26% was 60 jaar of ouder. Onder de patiënten met ‘overige infecties’ waren de meesten 60 jaar of ouder (figuur 2).
- Meer dan 95% van de patiënten had in ieder geval diarree (tabel 1). Patiënten met een STEC 0157-infectie hadden beduidend vaker bloed in de ontlasting en werden ook vaker opgenomen in het ziekenhuis. Bij 16% (13-21%) van de meldingen bleek dat er in de directe omgeving van de patiënt ook andere zieken waren, voornamelijk gezins-/huishoudcontacten.
- 14-17% van de patiënten met een getypeerde STEC-infectie had de infectie in het buitenland opgelopen. Dit percentage was 34 bij patiënten met een niet-getypeerde STEC-infectie.
Tabel 1. Kenmerken van STEC-infecties gemeld in 2018
| O157 (%) | STEC non-O157 (%) | Niet getypeerd (%) | |
| gegevens beschikbaar | 48/49 (98) | 71/75 (95) | 218/230 (95) |
| vleeseter | 46/48 (96) | 57/64 (89) | 173/179 (97) |
| biefstuk | 7/42 (17) | 3/56 (5) | 27/159 (17) |
| tartaar | 1/42 (2) | 4/56 (7) | 16/159 (10) |
| hamburger | 16/42 (38) | 23/56 (41) | 39/159 (25) |
| filet américain | 9/42 (21) | 15/56 (27) | 37/159 (23) |
| carpaccio | 4/42 (10) | 4/56 (7) | 15/159 (9) |
| rosbief | 2/42 (5) | 2/56 (4) | 12/159 (8) |
| ossenworst | 0/42 (0) | 0/56 (0) | 15/159 (9) |
| rauw of niet-gaar vlees gegeten | 13/42 (42) | 21/56 (38) | 70/159 (44) |
| kiemgroenten | 5/41 (12) | 10/55 (18) | 33/162 (20) |
| slasoorten | 28/41 (68) | 30/55 (55) | 101/162 (62) |
| rauwe melk | 5/40 (13) | 2/56 (4) | 11/159 (7) |
| rauwmelkse kaas | 2/40 (5) | 0/56 (0) | 7/159 (4) |
| contact met dieren | 25/47 (53) | 33/62 (53) | 87/179 (49) |
| contact met huisdieren | 23/47 (49) | 22/62 (35) | 79/179 (44) |
| contact met landbouwhuisdieren | 3/47 (6) | 9/62 (15) | 91/179 (5) |
| contact met mest | 8/45 (18) | 8/61 (13) | 7/176 (4) |
| immunosuppresiva | 1/46 (2) | 5/62 (8) | 22/178 (12) |
| maagzuurremmers | 4/46 (9) | 11/62 (18) | 50/178 (28) |
| cholesterolverlagers | 1/46 (2) | 7/62 (11) | 25/178 (14) |
| onderliggend lijden | 15/46 (33) | 26/60 (43) | 98/175 (56) |
- Bij 98%, 95% en 95% van de meldingen van patiënten met respectievelijk de STEC O157-, STEC non-O157- en niet-getypeerde STEC-infecties die in Nederland waren opgelopen of waarvan dit onbekend was, waren 1 of meer van de extra vragen beantwoord (tabel 2).
- Vrijwel alle patiënten met een STEC O157-infectie of een niet getypeerde STEC-infectie aten vlees (96-97%). Onder patiënten met een STEC non-O157-infectie is dit met 89% iets lager. Ossenworst werd alleen gegeten door patiënten met een niet-getypeerde STEC-infectie of met een ‘overige infectie’. Evenals in 2017, dronken patiënten met een STEC 0157-infectie vaker rauwe melk dan patiënten uit de andere 2 groepen.
- Vooral patiënten met een STEC O157- (18%) of non-O157 (13%) -infectie waren in contact geweest met mest.
- Patiënten met een niet-getypeerde STEC-infectie gebruikten vaker immunosuppressiva en maagzuurremmers en hadden vaker een onderliggende ziekte dan de 2 andere groepen patiënten.
- Het was niet mogelijk om een vergelijking te maken tussen de gemelde risicofactoren carpaccio, rauwmelkse kaas, contact met dieren en contact met huisdieren en de antwoorden van mensen die in 2018 mee hadden gedaan aan de controlesurvey.
- Uit de logistische regressieanalyse bleek dat contact met mest een risicofactor was voor besmetting met STEC O157 met een OR van 3,8 (95% BI 1,5-9,6).
- Voor STEC non-O157-infecties kwam het eten van biefstuk als ‘beschermend’ (0,3 (0,1-0,99)) uit het model en waren hamburgers (2,6 (1,3-5,2)) en gebruik van immunosuppressiva (19,1 (3,5-103,5) risicofactoren.
- De risicofactoren voor de niet-getypeerde infecties waren het eten van ossenworst (2,5 (1,1-5,6)), gebruik van immunosuppressiva (7,1 (2,2-23,6)) of maagzuurremmers (2,3 (1,3-4,1)), en onderliggend lijden (2,3 (1,5-3,7)).
Tabel 2. Voedselconsumptie, contact met dieren, medicijngebruik en onderliggende ziekte gerapporteerd door STEC-patiënten die niet in buitenland zijn geweest, 2018
| O157 (%) | STEC non-O157 (%) | Niet getypeerd (%) | |
| gegevens beschikbaar | 48/49 (98) | 71/75 (95) | 218/230 (95) |
| vleeseter | 46/48 (96) | 57/64 (89) | 173/179 (97) |
| biefstuk | 7/42 (17) | 3/56 (5) | 27/159 (17) |
| tartaar | 1/42 (2) | 4/56 (7) | 16/159 (10) |
| hamburger | 16/42 (38) | 23/56 (41) | 39/159 (25) |
| filet américain | 9/42 (21) | 15/56 (27) | 37/159 (23) |
| carpaccio | 4/42 (10) | 4/56 (7) | 15/159 (9) |
| rosbief | 2/42 (5) | 2/56 (4) | 12/159 (8) |
| ossenworst | 0/42 (0) | 0/56 (0) | 15/159 (9) |
| rauw of niet-gaar vlees gegeten | 13/42 (42) | 21/56 (38) | 70/159 (44) |
| kiemgroenten | 5/41 (12) | 10/55 (18) | 33/162 (20) |
| slasoorten | 28/41 (68) | 30/55 (55) | 101/162 (62) |
| rauwe melk | 5/40 (13) | 2/56 (4) | 11/159 (7) |
| rauwmelkse kaas | 2/40 (5) | 0/56 (0) | 7/159 (4) |
| contact met dieren | 25/47 (53) | 33/62 (53) | 87/179 (49) |
| contact met huisdieren | 23/47 (49) | 22/62 (35) | 79/179 (44) |
| contact met landbouwhuisdieren | 3/47 (6) | 9/62 (15) | 91/179 (5) |
| contact met mest | 8/45 (18) | 8/61 (13) | 7/176 (4) |
| immunosuppresiva | 1/46 (2) | 5/62 (8) | 22/178 (12) |
| maagzuurremmers | 4/46 (9) | 11/62 (18) | 50/178 (28) |
| cholesterolverlagers | 1/46 (2) | 7/62 (11) | 25/178 (14) |
| onderliggend lijden | 15/46 (33) | 26/60 (43) | 98/175 (56) |
Mogelijke bronnen van infectie
In 2018 werd bij 1 melding onderzoek gedaan op STEC in voedselmonsters omdat er een klacht was ingediend en/of de bron van infectie vermoedelijk aangewezen kon worden. Hierbij werd geen STEC gevonden.
De NVWA onderzocht in 2018 in 24 monitoringsprojecten de aanwezigheid van STEC in voedsel, vooral in retail vlees.
- Net als in 2017, bleek STEC vooral te zitten in vers vlees van kleine herkauwers - in 32 van de 247 monsters (13,0%) werd STEC aangetoond. Ook bereid vlees (gehakt, gekruid, etc.) werd (beperkt) gemonitord. Hierbij werd in 12 van 41 monsters STEC aangetoond (29,3%). Deze percentages waren hoger dan in 2017. In retail gehakt en vleesbereidingen (21 isolaten/ 310 monsters, 6,8%) en retail kalfsvlees (16/266, 6,0%) waren de percentages STEC-positieve monsters ook hoog.
- Voor de andere retail- vleesproducten waren de percentages duidelijk lager: rauw vlees voor consumptie (5/315; 1,6%) en vers rundvlees (8/313; 2,6%). In 2018 waren bij geïmporteerd exotisch vlees 4 van 44 monsters STEC-positief.
- In monsters van mosselen (70), oesters (23) en geïmporteerde kweekvis (304) werd geen STEC aangetoond.
- Van groenten en (verse) kruiden waren slechts 2 monsters van geïmporteerde verse kruiden positief.
- In geïmporteerd pluimveevlees (355 monsters) en landbouwhuisdieren (vleeskuikens, 793 monsters, 6 per bedrijf) werd geen STEC gevonden.
In 2018 werd in 107 voedselmonsters STEC aangetoond, met 44 verschillende O-groepen. Hierbij werd O146:H21 (n=16) het meest gevonden, gevolgd door O38:H26 (n=7) en O91:H14 (n=5).In 10 van de isolaten werd ook het eae-gen gevonden, waaronder 2 isolaten O26:H11 uit monsters lamsvlees, 2 isolaten O157:H7 uit kalf/rundvlees en 1 isolaat O145 uit lamsvlees.
Patiëntisolaten
- Van alle 59 STEC O157-patiënten was het isolaat beschikbaar, tweederde bevatte beide stx-genen (66%), 27% bevatte alleen het stx2-gen en 4 isolaten (7%) bevatte alleen het stx1-gen. Alle O157-isolaten bevatten het eae- en 58 het EHEC-hly-gen.
- Van de 87 beschikbare STEC non-O157-isolaten bevatten 38 (44%) isolaten alleen het stx1-gen, 42 (48%) isolaten alleen het stx2-gen (waarvan 4 (5%) het stx2f-gen) en 7 (8%) isolaten bevatten beide genen.
In totaal hadden 58 (67%) isolaten het eae- en het EHEC-hly-gen, 4 (5%) isolaten hadden alleen het eae-gen, 8 (9%) isolaten alleen het EHEC-hly-gen en 17 (20%) isolaten geen van beide genen.
- Binnen STEC non-O157 werd STEC O26 (n=23; 26%) het meest gevonden, op afstand gevolgd door STEC O103 (n=12; 14%) en STEC O8 (n=5; 6%). In totaal werden er 27 verschillende O-groepen gevonden, naast 4 niet-typeerbare en 2 auto-agglutinabele STEC’s.
Over de gehele periode 2007-2018 waren na O157 (n=819), O26 (n=234; 15%), O91 (n=141; 9%), O103 (n=114; 7%), O146 (n=102; 6%) en O63 (n=96; 6%) de 5 meest gevonden O-groepen.
Clusters aangetoond met WGS
Binnen de STEC O157-isolaten werden in 2018 op basis van WGS 6 clusters gevonden.
- Eén cluster leidde tot een landelijk uitbraakonderzoek. Dit cluster bestond uit 6 gemelde patiënten en 1 patiënt die niet aan de meldingsplicht voldeed: 5 mannen en 2 vrouwen: 1 peuter en 6 volwassenen van 20-39 jaar. De eerste ziektedagen van de patiënten lagen tussen 16 en 30 juli. De vermoedelijke besmettingsbron was filet américain maar dit werd niet microbiologisch bevestigd.
- Daarnaast was er een cluster met 7 patiënten in 2018 en 3 in augustus 2017, bestaande uit 2 mannen en 8 vrouwen, waaronder 2 kleuters, 2 tieners en 6 volwassenen in de leeftijd 25-63 jaar. De eerste ziektedagen in 2018 lagen in juni tot met augustus: 2-7 juni (3), 18 juli en 25-31 augustus (3). Twee volwassenen kregen HUS. Mogelijk dat kant-en-klare rauwkost de bron was, omdat 60% van de patiënten dit had gegeten. Ter vergelijking: uit de controlesurvey bleek dat in de periode 2008-2018 gemiddeld 29% van de patiënten ook kant-en-klare rauwkost – in dezelfde maanden –had gegeten.
- De overige 4 clusters bestonden elk uit 2 patiënten uit 2018. De patiënten van 1 van deze clusters waren ziek geworden in augustus, 4 dagen uit elkaar en er was sprake van een match met een patiënt uit september 2017. Bij de andere 3 clusters zat er minimaal 8 weken tussen de eerste ziektedagen van de patiënten en was er geen match met 2017. De beschikbare informatie liet verder geen duidelijke bron zien.
Er waren 3 STEC O26-clusters:
- Hieronder waren 2 gezinsclusters: eenmaal met 2 broertjes, die beiden HUS ontwikkelden en daarnaast matchten met 2 zusjes die in 2017 ziek werden en in dezelfde regio wonen, en eenmaal een moeder en zoontje.
- Bij het derde cluster lagen de 2 eerste ziektedagen van de patiënten 7 dagen uit elkaar, maar was er verder geen overeenkomst te zien op basis van de beschikbare informatie.
Bij STEC O8, O111 en O146 was er bij elke van deze typeringen 1 patiënt in 2018 die matchte met respectievelijk 1, 3 en 2 patiënten in 2017 zonder verdere aanwijzingen voor een onderlinge link.
Er waren 2 STEC O103-clusters:
- Een cluster met 4 patiënten waarbij er 2 regionaal clusteren en 3 in een periode van 5 dagen ziek werden, de vierde patiënt werd een maand later ziek.
- Een cluster met 2 patiënten uit 2018 en 2 uit 2017. Allen werden ziek in augustus en wonen in Noordoost-Nederland. De 2 patiënten in 2017 werden op dezelfde dag ziek, waarbij 1 van hen de besmetting vrijwel zeker in Azië had opgelopen.
Twee van de 3 STEC O63-patiënten behoorden tot het STEC O63-cluster, waartoe ook alle 7 patiënten uit 2017 behoren; het isolaat van de derde patiënt lag op 13 allelen afstand.
Discussie
De surveillance is sinds juli 2016 beperkt tot de acute infecties. Deze infecties lenen zich het beste voor (preventieve) GGD-acties tegen verdere verspreiding in de vorm van advies en voorlichting. De infecties geven een beter beeld van eventuele verheffingen dan chronische en/of vage klachten waarbij een STEC wordt gevonden. Het aantal meldingen in 2018 lag hoger dan in 2017, maar is - zoals verwacht - nog steeds lager dan voor het veranderen van de meldingscriteria. Vooral het aantal meldingen van infecties zonder STEC-typering is gestegen. Omdat het aantonen van een cluster zeer afhankelijk is van de beschikbaarheid van een STEC-typering en bevestiging van een cluster met behulp van WGS wordt gedaan, kan het ontbreken van een isolaat bij een groot deel van de meldingen een bedreiging vormen voor de surveillance. Dit omdat er dan geen goed landelijk beeld is van circulerende typen (wat zeker belangrijk is bij meer ernstige ziekte) en er geen adequate uitbraakdetectie/-onderzoek kan worden uitgevoerd. Er is dan ook een (lab)inf@ct-bericht naar de laboratoria gestuurd om in ieder geval van patiënten met een ziekenhuisopname, met bloed in ontlasting en/of die HUS hebben, een isolaat op te sturen voor typering. Dit betreft ongeveer de helft van de meldingen en dit zijn over het algemeen de meest ernstig zieke patiënten. Daarnaast zijn deze isolaten relatief eenvoudig door de laboratoria te selecteren.
STEC O26 en O103 werden, na STEC O157, het meest aangetroffen. Deze 3 O-types geven een verhoogd risico op een ernstig verloop van de ziekte, inclusief HUS. (6-10) STEC O26 heeft sinds STEC non-O157 is opgenomen in de surveillance in Nederland, elk jaar in de top 3 van meest voorkomende O-types gestaan. Hoewel STEC O26 minder voorkomt dan STEC O157 is de infectie qua ernst zeker belangrijk. In 2018 ontwikkelden 6 van 23 patiënten (26%) met een STEC O26-infectie, HUS, ten opzichte van 5 van 59 patiënten (8%) met een STEC O157-infectie.
In voedselmonsters werden voornamelijk O146:H21, O38:H26 en O91:H14 gevonden. Onder de humane STEC-infecties in 2018 waren 1 O146:H21 en 1 O146:H28, geen O38 en 1 O91:H14. Er werden in 2018 met WGS geen clusters gevonden met zowel patiënt- als voedselisolaten. Recent is een Nederlandse attributiestudie uitgevoerd met gegevens en isolaten van patiënten en runderen, schapen en geiten, varkens en pluimvee uit de surveillance van 2011 tot en met 2014. (2) Daaruit blijkt dat aan ongeveer de helft van alle STEC-patiënten runderen als reservoir kon worden toegeschreven en de O-types O157, O26, O91 en O103 zelfs voor 61-75%. Ongeveer een kwart van de infecties kon worden toegeschreven aan schapen en geiten, en 71-77% van de STEC O146-infecties. Varkens en pluimvee waren kleinere reservoirs van STEC.
Naar medicijngebruik en onderliggende ziekten werd eerder niet in de aparte vragenlijst gevraagd. Vooral de patiënten met een niet-getypeerde STEC-infectie leken vaker medicijnen - met name immunosuppressiva en maagzuurremmers - te gebruiken en onderliggende ziekten te hebben in vergelijking tot de respondenten die in 2018 mee deden aan de controle-survey. (11) Gebruik van immunosuppressiva was ook een risicofactor voor een non-O157-infectie.
WGS is een betrouwbare en een relatief snelle methode voor clusterdetectie en -bevestiging. (12) Sinds 2017 zijn zowel van de patiënt- als van de voedselisolaten WGS-gegevens beschikbaar. Dit leverde geen link op tussen beide groepen. Een van de redenen kan zijn dat de NVWA steekproefsgewijs test, terwijl een product vaak maar korte tijd (1 of enkele partijen) besmet zal zijn. Wel werd met behulp van WGS een landelijke uitbraak van STEC O157 gevonden, bestaande uit 6 gemelde patiënten en 1 patiënt die niet aan de meldingscriteria voldeed. De laatste landelijke uitbraak dateerde van 2009. (13) Uit het vragenlijstonderzoek kwam filet américain als meest waarschijnlijke bron naar voren, maar dit kon microbiologisch niet bevestigd worden. Ook in de landelijke uitbraken van 2005 en 2009 was filet américain de meest waarschijnlijke bron. (13-15) Daarmee lijken vleesproducten die rauw geconsumeerd worden nog steeds een risico te vormen voor de volksgezondheid. Er was in 2018 nog een tweede, relatief groot cluster met 7 patiënten, naast 3 patiënten in 2017. Door de verspreiding van de eerste ziektedagen over een grotere periode werd er geen uitbraakonderzoek uitgevoerd. Op basis van de gegevens uit Osiris zouden kant-en-klare (gesneden) groenten de oorzaak geweest kunnen zijn. Voorgesneden sla heeft in 2007 al eens een uitbraak in Nederland en IJsland veroorzaakt. (16)
Vorig jaar viel op dat vooral STEC O63 sterk clusterde. Twee van de 3 patiënten uit 2018 vielen ook in dat cluster, 1 patiënt had een iets afwijkende stam. Het lijkt erop dat STEC O63-stammen die in Nederland tot nu toe gezien zijn weinig spreiding laten zien. STEC O63-isolaten bevatten altijd het stx2f-gen, wat in de meeste gevallen een milde infectie veroorzaakt. (17) Duiven werden als mogelijk reservoir van stx2f-bevattende E.coli’s gezien, maar een vergelijking op basis van WGS van isolaten uit duiven en humane isolaten, liet zien dat het vaak om verschillende serotypes en aparte subclusters gaat. (18) Het reservoir van humane stx2f-STEC blijft daarmee grotendeels onopgehelderd. Vooral bij STEC O63 zou mens-op-menstransmissie een belangrijke rol kunnen spelen.
De focus van de STEC-surveillance ligt sinds juli 2016 op acute infecties. Met de invoering van de nieuwe meldingscriteria is het aantal meldingen gedaald, maar het aandeel meldingen zonder isolaat (of WGS- gegevens) stijgt. Dit vormt een bedreiging voor de surveillance, aangezien clusterdetectie zeer afhankelijk is van de beschikbaarheid van een STEC-typering en bevestiging van een cluster met behulp van WGS wordt gedaan. STEC O157 blijft de belangrijkste verwekker van STEC-infecties in Nederland, zowel in voorkomen als in ernst, gevolgd door STEC O26. In niet-humane isolaten werden voornamelijk STEC O146, O38 en O91 aangetroffen, maar ook in mindere mate O26 en O157. De overstap naar WGS voor alle STEC-isolaten heeft de clusterdetectie versneld en verbeterd.
Wij bedanken alle GGD'en en medisch microbiologische laboratoria hartelijk voor hun medewerking bij het verzamelen van de patiëntgegevens en het insturen van isolaten. Ook bedanken we de medewerkers van de NVWA voor het bemonsteren van en onderzoek naar landbouwhuisdieren en (verdacht) voedsel.
Auteurs
I.H.M. Friesema (1), S. Kuiling (1), M. van der Voort (2), P.H. in ’t Veld (2), M.E.O.C. Heck (1), E. Franz (1)
- Centrum Infectieziektebestrijding, Rijksinstituut voor Volksgezondheid en Milieu, Bilthoven
- Divisie Handhaving, Nederlandse Voedsel- en Warenautoriteit
Correspondentie
Literatuur
- Smith J.L., Fratamico P.M., Gunther N.W. Shiga Toxin-Producing Escherichia coli. Advances in applied microbiology 2014; 86: 145-97.
- Mughini-Gras L., van Pelt W., van der Voort M., Heck M., Friesema I., Franz E. Attribution of human infections with Shiga toxin-producing Escherichia coli (STEC) to livestock sources and identification of source-specific risk factors, The Netherlands (2010-2014). Zoonoses Public Health 2018; 65: e8-e22.
- Friesema I.H., Van De Kassteele J., De Jager C.M., Heuvelink A.E., Van Pelt W. Geographical association between livestock density and human Shiga toxin-producing Escherichia coli O157 infections. Epidemiol Infect 2011; 139: 1081-7.
- Friesema I.H., van Gageldonk-Lafeber A.B., van Pelt W. Extension of traditional infectious disease surveillance with a repeated population survey. Eur J Public Health 2015; 25: 130-4.
- Derzelle S., Grine A., Madic J., et al. A quantitative PCR assay for the detection and quantification of Shiga toxin-producing Escherichia coli (STEC) in minced beef and dairy products. International Journal of Food Microbiology 2011; 151: 44-51.
- Bruyand M., Mariani-Kurkdjian P., Gouali M., et al. Hemolytic uremic syndrome due to Shiga toxin-producing Escherichia coli infection. Medecine et maladies infectieuses 2018; 48: 167-74.
- Naseer U., Lobersli I., Hindrum M., Bruvik T., Brandal L.T. Virulence factors of Shiga toxin-producing Escherichia coli and the risk of developing haemolytic uraemic syndrome in Norway, 1992-2013. Eur J Clin Microbiol Infect Dis 2017; 36: 1613-20.
- Gould L.H., Mody R.K., Ong K.L., et al. Increased Recognition of Non-O157 Shiga Toxin-Producing Escherichia coli Infections in the United States During 2000-2010: Epidemiologic Features and Comparison with E. coli O157 Infections. Foodborne Pathog Dis 2013; 10: 453-60.
- Käppeli U., Hächler H., Giezendanner N., Beutin L., Stephan R. Human infections with non-O157 Shiga toxin-producing Escherichia coli, Switzerland, 2000-2009. Emerg Infect Dis 2011; 17: 180-5.
- Newell D.G., La Ragione R.M. Enterohaemorrhagic and other Shiga toxin-producing Escherichia coli (STEC): Where are we now regarding diagnostics and control strategies? Transbound Emerg Dis 2018: doi: 10.1111/tbed.12789.
- Friesema I.H.M., van Gageldonk-Lafeber A.B., Van Pelt W. Extension of traditional infectious disease surveillance with a repeated population survey Eur J Public Health 2015; 25: 130-4.
- Jenkins C., Dallman T.J., Grant K.A. Impact of whole genome sequencing on the investigation of food-borne outbreaks of Shiga toxin-producing Escherichia coli serogroup O157:H7, England, 2013 to 2017. Euro Surveill 2019; 24.
- Greenland K., de Jager C., Heuvelink A., et al. Nationwide outbreak of STEC O157 infection in the Netherlands, December 2008-January 2009: continuous risk of consuming raw beef products. Euro Surveill 2009; 14: pii=19129.
- Doorduyn Y., de Jager C.M., van der Zwaluw W.K., et al. Shiga toxin-producing Escherichia coli (STEC) O157 outbreak, The Netherlands, September - October 2005. Euro Surveill 2006; 11: 182-5.
- Doorduyn Y., de Jager C.M., van der Zwaluw W.K., et al. Filet américain oorzaak van eerste landelijke uitbraak van Shiga toxineproducerende E. coli O157-infecties. Infectieziekten Bulletin 2006; 17: 288-92.
- Friesema I., Sigmundsdottir G., van der Zwaluw K., et al. An international outbreak of shiga toxin-producing Eschericha coli O157 infection due to lettuce, September-October 2007. Euro Surveill 2008; 13: 18-22.
- Friesema I., van der Zwaluw K., Schuurman T., et al. Emergence of Escherichia coli encoding Shiga toxin 2f in human Shiga toxin-producing E. coli (STEC) infections in the Netherlands, January 2008 to December 2011. Euro Surveill 2014; 19.
- van Hoek A., van Veldhuizen J.N.J., Friesema I., et al. Comparative genomics reveals a lack of evidence for pigeons as a main source of stx2f-carrying Escherichia coli causing disease in humans and the common existence of hybrid Shiga toxin-producing and enteropathogenic E. coli pathotypes. BMC Genomics 2019; 20: 271.