Infectieziekten Bulletin
Oktober 2018 | Jaargang 29, nummer 8
https://magazines.rivm.nl/2018/10/infectieziekten-bulletin
Gesignaleerd
Binnenlandse signalen
Kinkhoest bij verloskundigen
Medio juli kreeg de GGD Amsterdam een melding van kinkhoest bij een verloskundige. De verloskundige werd behandeld met antibiotica en werd geadviseerd om te stoppen met werken totdat de besmettelijke periode voorbij was. Tijdens de besmettelijke fase had de verloskundige een aantal keren een bevalling begeleid. In die gezinnen werd chemoprofylaxe geadviseerd voor alle gezinsleden die daarbij aanwezig waren geweest. In geval de aanstaande moeders tijdens de zwangerschap tegen kinkhoest gevaccineerd waren, kon chemoprofylaxe achterwege gelaten worden. Verder werd de verloskundige geadviseerd om alle cliënten met wie zij in de besmettelijke periode contact had gehad per brief te informeren. Cliënten die meer dan 34 weken zwanger waren en bezoek hadden gekregen van de verloskundige en clienten waar de verloskundige op kraambezoek was geweest, werden telefonisch op de hoogte gebracht. De collega ’s van de verloskundige en de kraamverzorgenden haar bij de bevallingen hadden geassisteerd werden geadviseerd om alert te zijn op klachten en in geval van klachten te stoppen met werken en diagnostiek af te laten nemen. Enkele dagen na de melding bleek een collega klachten te hebben en zij was PCR-positief voor Bordetella pertussis. Dezelfde maatregelen werden geadviseerd.
De Gezondheidsraad bracht in juni 2017 het advies uit om alle personen die werkzaam zijn met kinderen ≤ 6 maanden elke 5 jaar te vaccineren tegen kinkhoest. Deze maatregel was in de betreffende verloskundigenpraktijk nog niet ingevoerd. De verloskundigen laten zich nu alsnog vaccineren, en hebben het advies van de Gezondheidsraad opnieuw verspreid binnen hun beroepsgroep. Er zijn in deze casus geen andere patiënten met kinkhoest gemeld. Een fysiotherapeut die op dezelfde locatie werkzaam was werd in dezelfde periode ook gemeld met kinkhoest, het onderlinge contact met de bevestigde verloskundigen bleek echter verwaarloosbaar. (Bronnen: RIVM, LCI, GGD Amsterdam)
Tekenencefalitis in Nederland
Tot nu toen is bij 5 Nederlandse patiënten een infectie met tekenencefalitisvirus (TBEV) vastgesteld. De infectie werd in 3 van de 5 gevallen opgelopen in Duitsland en 2 patiënten liepen de infectie op in Nederland, zeer waarschijnlijk in Twente en op de Utrechtse Heuvelrug. Alle patiënten waren positief in zowel TBE IgM als IgG-serologie. Niet alle patiënten hadden het typische bifasische beloop.In Duitsland neemt het aantal patiënten met tekenencefalitis toe. In 2017 werden 485 patiënten gemeld, 40% meer dan in 2016. Ook in 2018 zijn tot en met week 26 opnieuw meer patiënten gemeld dan in dezelfde periode in 2017 (zie voor TBE-risicogebieden in Duitsland https://www.zecken.de/en/tbe-germany).
Alertheid op TBE, ook wanneer een patiënt niet naar het buitenland is geweest, is van belang. Het advies is om bij patiënten met neurologische klachten passend bij TBE diagnostiek hiernaar in te zetten. (Bronnen: RIVM, UMCG, ErasmusMC, LabMicta)
Buitenlandse signalen
Uitbraak van cholera in Algerije
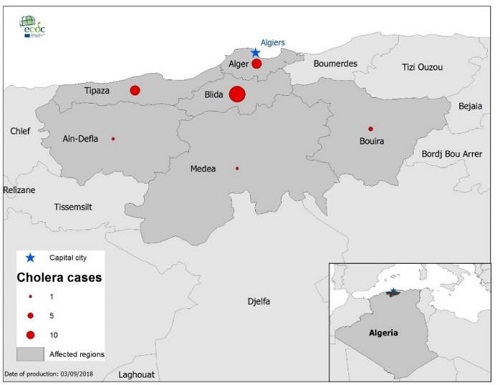
Sinds 7 augustus is er een cholera uitbraak van cholera in 6 gebieden in Algerije: Bouira, Blida, Tipaza, Algiers en Medea (Figuur 1). Dit is de eerste uitbraak van cholera in Algerije sinds 20 jaar. Institut Pasteur in Algerije heeft bij 83 van de 217 waarschijnlijke patiënten de diagnose bevestigd. 2 patiënten zijn overleden. Met laboratoriumonderzoek is Vibrio cholerae O1 Serotype Ogawa aangetoond. Een natuurlijke waterbron in Tipiza bleek verontreinigd met Vibrio cholera; de gezondheidsautoriteiten hebben de bron afgesloten. Een risico-analyse van het European Centre of Disease Prevention and Control (ECDC) schat het risico op introductie en verspreiding in Europa via besmette reizigers als zeer laag. (Bronnen: Algerijnse Ministerie van Volksgezondheid, Institut Pasteur, ECDC)
Figuur 1. Geografische distributie van cholerapatiënten in Algerije, 7 tot 30 augustus 2018.(Bron ECDC)
Grote legionella-uitbraak in het noorden van Italië
De regionale gezondheidsautoriteiten van Brescia meldden in de tweede week van september een uitbraak van longontsteking in de regio Brescia, in het noorden van Italië. Tot 20 september is het aantal patiënten met longontsteking opgelopen tot 405, waarvan bij 42 personen de diagnose legionellose is gesteld. Vooralsnog zijn geen Nederlandse patiënten gerelateerd aan deze uitbraak. Van het totaal aantal patiënten met een longontsteking is 66% man en is de gemiddelde leeftijd 65 jaar. Een brononderzoek is gestart waarbij meerdere watermonsters zijn afgenomen uit woningen, van koeltorens, het waterleidingnetwerk en de rivier de Chiese. Tien monsters afkomstig van de koeltorens van 3 bedrijven uit deze regio, zijn tot nu toe geanalyseerd, hiervan waren er 9 positief voor Legionella spp. Een besmette koeltoren zou hiermee mogelijk een oorzaak van deze uitbraak kunnen zijn. Aanvullend typeringsonderzoek van omgevingsmonsters en patiënten kan hier meer duidelijkheid over geven. (Bronnen: media, promed)
Auteur
S. Raven, Centrum Infectieziektebestrijding, RIVM
Correspondentie
Waterpokken in Caribisch Nederland: een onschuldige kinderziekte?
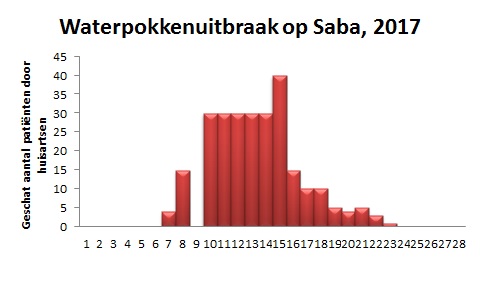
Gedurende het eerste half jaar van 2017 kregen naar schatting tenminste 250 mensen op Saba waterpokken. Saba is een eiland in het Caribisch gebied en is een bijzondere gemeente van Nederland. De uitbraak was qua omvang aanzienlijk, gezien het inwoneraantal van 1500 op het eiland. Op basis van informatie van de huisartsen, grote werkgevers op het eiland en scholen schatten we dat eenderde deel van de zieken volwassenen was. Hieronder waren 3 zwangere vrouwen. 2 patiënten werden met een varicellapneumonie overgevlogen naar St. Maarten. Waterpokken hebben een andere epidemiologie in de tropen en mede door logistieke uitdagingen zijn Nederlandse richtlijnen niet altijd bruikbaar in het Caribisch deel van Nederland.
Waterpokken in Caribisch Nederland: een onschuldige kinderziekte?
Waterpokken in de tropen
De epidemiologie van waterpokken is in de tropen anders dan in gematigde klimaten: een groot deel van de volwassenen is seronegatief voor varicellazostervirus (VZV) en dus nog vatbaar voor besmetting. (1) De oorzaak van dit verschil is nog niet bekend, maar factoren als viruseigenschappen, het klimaat, verschillen in blootstelling en populatiedichtheid lijken een rol te spelen. (2) De totale ziektelast van waterpokken is ook hoger in de tropen dan in gematigde klimaten: het risico van zwangere vrouwen in de tropen om waterpokken te krijgen is dus groter, waarbij het congenitaalvaricellasyndroom een ernstige complicatie is van een tijdens de zwangerschap opgelopen infectie. Daarnaast neemt de kans op complicaties bij waterpokken (met name de moeilijk te behandelen varicellapneumonie) toe naarmate de zwangere vrouw ouder is. (3)
Alhoewel Aruba, Curaçao en St. Maarten, en de bijzondere gemeenten Bonaire, St. Eustatius en Saba onderdeel zijn van Nederland, zijn er geen cijfers bekend over de ziektelast van waterpokken of de VZV-serostatus op populatieniveau. Op Bonaire, St. Eustatius en Saba heeft recent wel een groot gezondheidsonderzoek plaatsgevonden waar PIENTER (bepaling van de seroprevalentie van onder andere VZV) onderdeel van uitmaakte; de resultaten worden later in 2018 verwacht.
Figuur 1. Epicurve van de uitbraak zoals geregistreerd in de wekelijkse huisartsenrapportage van infectieuze syndromen
Uitdagingen bij de uitbraak op Saba
Logistiek
De uitbraak op Saba veroorzaakte onrust omdat veel zwangere vrouwen en andere volwassenen anamnestisch geen waterpokken hadden doorgemaakt. Het achterhalen van een serostatus na blootstelling, zoals in Nederland gebruikelijk is alvorens te besluiten over postexpositieprofylaxe (PEP) met vaccinatie of het toedienen van varicellazosterimmunoglobulinen (VZIG), was geen optie omdat het 2 tot 3 weken duurt voordat serologie-uitslagen bekend zijn. In overleg met ons - de GGD - besloot de huisarts om zwangere vrouwen serologie aan te bieden
Een tweede logistieke moeilijkheid was het feit dat VZIG heel moeilijk verkrijgbaar is. Het lukte de apotheek na zeer veel moeite om 1 dosis te krijgen, maar toen was de uitbraak al duidelijk aan het afnemen en was de noodzaak voor PEP niet meer aanwezig.
Verschillende inzichten rond wering op scholen
De uitbraak gaf ook aanleiding tot boosheid onder de bevolking. De GGD besloot, omdat wering, volgens de richtlijn Waterpokken van de Landelijke Coördinatie Infectieziektebestrijding (LCI) niet noodzakelijk is voor de volksgezondheid, dat kinderen met waterpokken weer naar school konden zodra ze zich beter voelden. Dit was nieuw op Saba en ook in tegenspraak met de richtlijnen van bijvoorbeeld de Amerikaanse Centres for Disease Control and Prevention (CDC) en veel andere landen, die strikte wering adviseren tot de besmettelijke fase geheel voorbij is.
Het besluit was bedoeld om het werkverzuim van ouders laag te houden omdat uit studies is gebleken dat het weren van kinderen van scholen niet tot minder besmettingen leidt. (4) De uitbraak werd echter veel groter en het totale school- en werkverzuim steeg ook snel. Of het beleid om kinderen niet te weren van kinderen van school dan ook een rol speelde in de groei van de uitbraak is niet helder. Andere factoren kunnen ook een rol hebben gespeeld. Er was bijvoorbeeld op school net een airconditioningsysteem aangelegd. Waar vroeger ramen en muren open waren en de wind vrij spel had, is het mogelijk dat blootstelling aan het waterpokkenvirus in een afgesloten ruimte, nu langer en groter is geweest. Het is echter ook zeker mogelijk dat de vatbaarheid van veel volwassenen en broertjes en zusjes in de thuissituatie de dynamiek van de uitbraak heeft beïnvloed en dat onder deze omstandigheden wering vanaf het begin wel had uitgemaakt. Bij volgende uitbraken in Caribisch Nederland verdient verslaglegging de aandacht, om weringsbesluiten beter te kunnen onderbouwen.
Discussie
Op Saba wordt het Nederlandse Rijksvaccinatieprogramma (RVP) gevolgd; hierin is geen waterpokkenvaccinatie opgenomen. In sommige omringende landen in de Amerika’s (onder andere de Verenigde Staten, Brazilië, Puerto Rico) wordt echter al geruime tijd standaard tegen waterpokken gevaccineerd. Het heeft daar tot een aanzienlijke daling van complicaties en totale ziektelast van waterpokken geleid, zonder dat de afname van circulerend virus tot een toename van gordelroos geleid lijkt te hebben. (4)
Veel Sabanen, die vaak zelf in Amerika hebben gewoond of gestudeerd of daar familie hebben, vroegen dan ook waarom alle onrust, bezorgde zwangeren, ziekteverzuim en behandelingen van volwassenen met ernstige waterpokken niet deels voorkomen had kunnen worden met een veilig vaccin. We moesten daarop het antwoord schuldig blijven. De Gezondheidsraad heeft in 2007 geoordeeld dat waterpokken in Nederland op dat moment geen urgent volksgezondheidsprobleem was en dat vaccinatie opnieuw zou moeten worden beoordeeld zodra nieuwe gegevens beschikbaar zijn. (6) Vanwege het effect van waterpokkenvaccinatie in andere landen en gezien de uitbraak op Saba is het goed dat de Gezondheidsraad de waterpokkenvaccinatie opnieuw op de agenda van 2019 heeft gezet.
Conclusies
De grote uitbraak van waterpokken op Saba illustreert dat besluiten en richtlijnen niet altijd voor heel Nederland goed toepasbaar zijn. In de tropische regio is er sprake van andere epidemiologie en andere logistieke omstandigheden.
De auteurs zijn Alies van Lier (RIVM, Centrum Infectieziektebestrijding) zeer erkentelijk voor haar kritisch meelezen en aandragen van relevante literatuur.
Auteurs
K. Hulshof1, G. Koot1,2,
1. GGD Saba
2. Saba Healthcare Foundation
Correspondentie
Literatuur
- Maria L. Ávila-Agüero, Sandra Beltrán, José Brea del Castillo, et al. Varicella epidemiology in Latin America and the Caribbean. Expert Review of Vaccines, (2018) 17:2, 175-183.
- WHO’s SAGE Working Group on Varicella and Herpes Zoster Vaccine: Background paper on Varicella Vaccine 2014. http://www.who.int/immunization/sage/meetings/2014/april/1_SAGE_varicella_background_paper_FINAL.pdf
- LCI Richtlijn Waterpokken: https://lci.rivm.nl/richtlijnen/waterpokken-en-gordelroos
- MacDonald NE. School and daycare exclusion policies for chickenpox: A rational approach. Canadian pediatric society. Pediatric Child Health 1999;4(4)287-288. Reaffirmed Feb 2018.
- Hales CM, Harpaz R, Joesoef MR, Bialek SR (2013). Examination of links between herpes zoster incidence and childhood varicella vaccination. Annals of Internal Medicine. 159(11):739-45
- Gezondheidsraad. De toekomst van het Rijksvaccinatieprogramma: naar een programma voor alle leeftijden. Den Haag: Gezondheidsraad; 2007. Publicatienr. 2007/02.
Hepatitis A onder MSM
Hepatitis A onder MSM
Wereldwijd is er sinds 2015 sprake van een uitbraak van hepatitis A onder mannen die seks hebben met mannen (MSM). (1-10) Sinds de tweede helft van 2016 speelt de uitbraak ook in Nederland onder MSM. (4) Opvallend aan de uitbraak is dat er binnen deze uitbraak 3 verschillende stammen circuleren, onder de namen VRD_521_2016 (VK/Spanje), RIVM-HAV16-090 (Europride) en V16_25801 (Duitsland). (1-5, 9) In dit artikel bespreken we de impact van de uitbraak op het aantal meldingen en verspreiding van het virus van de risicogroep van MSM naar de algemene bevolking in Nederland.
Communicatie rond de uitbraak
Tijdens landelijke uitbraken van infectieziekten zorgt het Centrum Infectieziektebestrijding van het RIVM samen met de GGD’en normaalgesproken voor de publiekscommunciatie. Bij deze uitbraak van hepatitis A werd ook de expertise van Soa Aids Nederland ingezet. Zij kennen de risicogroep van MSM goed, en zij kunnen hen via bestaande communicatiekanalen snel en effectief bereiken.
Seksueel overdraagbare aandoeningen in Nederland in 2017
Het Rijksinstituut voor Volksgezondheid en Milieu (RIVM) presenteert jaarlijks de landelijke trends van seksueel overdraagbare aandoeningen (soa) in Nederland in het soa/hiv jaarrapport. Hierin worden cijfers gepresenteerd van de Centra Seksuele Gezondheid (CSG), gegevens van het NIVEL (Nederlands instituut voor onderzoek van de gezondheidszorg) en van andere registratiebronnen met betrekking tot soa en/of hiv, zoals de Stichting HIV Monitoring. In dit artikel worden de belangrijkste bevindingen uit het jaarrapport van 2017 samengevat. Het volledige rapport is beschikbaar via www.rivm.nl/soahiv.
Seksueel overdraagbare aandoeningen in Nederland in 2017
Soaconsulten
In 2017 werden bij de CSG 150.593 consulten geregistreerd, een toename van 5% ten opzichte van 2016. Bij de CSG kunnen mensen die tot een hoogrisicogroep behoren zich volgens een landelijk afgestemd triagesysteem kosteloos op soa laten testen. Tot de hoogrisicogroep behoren, onder andere, mannen die seks hebben met mannen (MSM), mensen die voor een soa gewaarschuwd zijn door een (ex-)partner, mensen met aan soa gerelateerde klachten en jonge mensen onder de 25 jaar.
In 2017 was het soavindpercentage 18,4% en was daarmee gelijk aan 2016. Het soavindpercentage is het percentage consulten op de CSG waarbij 1 of meer soa gediagnosticeerd worden. Het percentage verschilt sterk per (risico)groep:
- Onder vrouwen en onder heteroseksuele mannen stegen de vindpercentages vanaf 2013, maar bleven in 2017 stabiel op 16,3% en 19,6%.
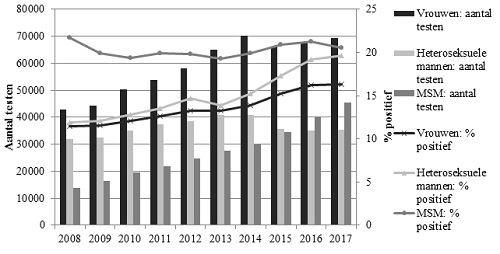
- Bij MSM was het vindpercentage 20,5% en dit is min of meer hetzelfde als de jaren ervoor (Figuur 1).
- De hoogste vindpercentages werden gezien bij mensen die gewaarschuwd waren voor een soa (33,0%) en bij mensen die hivpositief waren (32,5%).
- Het vindpercentage bij hivpositieve mensen was lager dan in 2016.
- De vindpercentages onder mensen met klachten (25,1%) en mensen die in het afgelopen jaar al eerder een soa hadden (25,1%) waren ook hoger dan het gemiddelde vindpercentage.
De vindpercentages per GGD-regio varieerden van 14,7% tot 21,7%.
Figuur 1. Totaal aantal testen en het percentage positieve testen bij de CSG naar geslacht en seksuele voorkeur, 2008-2017
De cijfers van 2017 over soa in de huisartsenpraktijk zijn nog niet beschikbaar. Zij komen uit de NIVEL Primary Care Database. Deze cijfers zijn een schatting gebaseerd op de cijfers van 350 huisartsenpraktijken en geëxtrapoleerd naar de Nederlandse populatie.Net als in voorgaande jaren waren in 2016 de meeste soaconsulten bij de huisarts. Het totaal aantal aan soa gerelateerde episodes (een infectie of angst voor soa) steeg van 267.400 naar ongeveer 281.300 en was daarmee bijna het dubbele van het aantal CSG-consulten. Ook het aantal soagerelateerde episodes per 1.000 inwoners steeg in 2016 van 15,9 naar 16,9, voornamelijk onder personen ouder dan 25 jaar.
Chlamydia
Chlamydia wordt veroorzaakt door Chlamydia trachomatis en is de meest voorkomende bacteriële soa bij de CSG. In 2017 werd bij 21.404 mensen chlamydia vastgesteld, een toename van 3% ten opzichte van 2016:
- De meeste infecties werden gevonden bij jongeren onder de 25 jaar (64%).
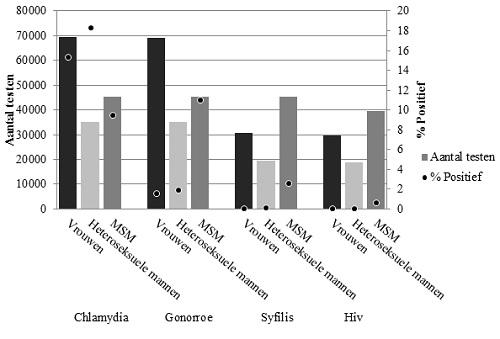
- Vindpercentages waren bij vrouwen en heteroseksuele mannen hoger (15,4% en 18,3%) dan bij MSM (9,5%) (Figuur 2).
- Het aantal LGV-diagnoses (lymfogranuloma venereum, een infectie met een invasieve variant van Chlamydia trachomatis) nam opnieuw toe maar het vindpercentage bleef stabiel.
- Het geschatte aantal chlamydia-episodes bij huisartsen (36.500) was vrijwel stabiel ten opzichte van 2016, maar nam licht toe onder mensen ouder dan 25 jaar. Het aantal episodes per 1.000 inwoners bleef gelijk.
Figuur 2.Totaal aantal testen en percentage positieve testen voor chlamydia, gonorroe, syfilis en hiv bij de CSG naar geslacht en seksuele voorkeur, 2017
Gonorroe
De meest voorkomende soa na chlamydia is gonorroe. Gonorroe wordt veroorzaakt door de bacterie Neisseria gonorrhoeae. Het aantal gonorroediagnoses op de CSG was 6.764. Dit is een stijging van 11% ten opzichte van 2016:
- Het vindpercentage onder vrouwen en heteroseksuele mannen ligt al jaren stabiel onder de 2%.
- Het vindpercentage onder MSM steeg de afgelopen jaren maar nam in 2017 licht af ten van 11,3% in 2016 naar 11,0% (Figuur 2). Dit betekent dat in 2017 gonorroe bij MSM vaker voorkwam dan chlamydia.
- Het geschatte aantal gonorroe-episodes bij de huisarts was 9.000 in 2016 (7.900 in 2015). Deze toename was vooral onder personen ouder dan 25 jaar.
- Binnen het project Gonokokken Resistentie tegen Antibiotica Surveillance (GRAS) bij de CSG werd nog geen resistentie gerapporteerd tegen ceftriaxon, het eerstekeusantibioticum tegen gonorroe. Wel nam de resistentie tegen azitromycine opnieuw toe, en kwam nu voor bij 15% van de op resistentie geteste patiënten.
Syfilis
Syfilis wordt veroorzaakt door de bacterie Treponema pallidum. In 2017 werden 1.228 patiënten met infectieuze syfilis gediagnosticeerd bij de CSG, Dit aantal is bijna hetzelfde als in 2016 (1.223):
- 95% van de patiënten waren MSM. Het vindpercentage onder MSM nam tot en met 2016 jaarlijks toe, maar daalde in 2017 van 2,9% (in 2016) naar 2,6%. Dit is voornamelijk te verklaren door een daling van het vindpercentage onder hivpositieve MSM (van 8,4% in 2016 naar 7,2% in 2017). Het vindpercentage onder hivnegatieve MSM bleef stabiel.
- Het vindpercentage onder vrouwen en heteroseksuele mannen is al jaren zeer laag (respectievelijk 0,09% en 0,16%) (Figuur 2).
Hiv
Bij de CSG werden in 2017 286 nieuwe hivinfecties gediagnosticeerd. Dit is vrijwel evenveel als in 2016 (285).
- 89% van deze diagnoses werden gesteld bij MSM. Het vindpercentage voor hiv onder MSM neemt al jaren af en staat inmiddels op 0,7% (Figuur 2).
- Bij de CSG werden 30 nieuwe hivinfecties gevonden bij vrouwen en heteroseksuele mannen. 83% van hen was afkomstig uit een hivendemisch land.
Bij de Stichting HIV Monitoring werden in 2017 1.037 nieuwe personen met hiv aangemeld in zorg (1.047 in 2016). Bij de hivbehandelcentra stonden in totaal 19.677 personen met hiv in zorg geregistreerd in 2017. Hiervan was 62,8% MSM.Opvallend is dat 45% van de nieuwe patiënten in 2017 laat in zorg kwam (CD4 <350/mm3 of aids). Dit percentage is lager voor MSM (38%) dan voor vrouwen (53%) en heteroseksuele mannen (63%). Nederland voldeed in 2017 bijna aan de Joint United Nations Programme on HIV/aids (UNAIDS) 90-90-90-doelen; geschat werd dat 89% van alle mensen met hiv gediagnosticeerd was en aangemeld in zorg. 92% van hen was ook gestart met behandeling, en daarvan was bij 95% het virus ook onderdrukt (1).
Genitale wratten en genitale herpes
In 2016 werden door huisartsen naar schatting 37.500 diagnoses van genitale wratten en 22.500 diagnoses van genitale herpes gesteld. Bij de CSG waren het in 2017 respectievelijk 1.619 en 531 diagnoses. Dit aantal ligt een stuk lager omdat de CSG geen routinematig onderzoek doen naar genitale wratten en genitale herpes
Hepatitis B en C
In 2017 werden bij de CSG 93 mensen met hepatitis B (zowel acuut als chronisch) gediagnostiseerd. Vanwege de meldingsplicht voor acute hepatitis B werden 114 meldingen gedaan, vergelijkbaar met 2016 (111 meldingen). Seksueel contact was de vaakst gerapporteerde transmissieroute (69%). Het aantal gevallen van acute hepatitis C in de meldingcijfers fluctueert sinds 2011 rond de 60 per jaar (58 in 2017). De belangrijkste transmissieroute van acute hepatitis C was seksueel contact tussen mannen.
Conclusies
Het aantal soaconsulten steeg opnieuw, zowel bij de CSG als bij huisartsen. Het vindpercentage per soa bleef echter overwegend stabiel.
Naast surveillance van soa en van hoogrisicogroepen, is het belangrijk om zicht te houden op de mensen in laagrisicogroepen, die zich bij andere zorgaanbieders laten testen of een zelftest doen.
Net als in voorgaande jaren bestond de hoogrisicogroep voor soa uit mensen die aan soa gerelateerde klachten rapporteerden, mensen die gewaarschuwd waren voor een soa, mensen met hiv en mensen die in het afgelopen jaar eerder een soa hadden. De hoge vindpercentages bij deze groep suggereren dat verdere inspanningen zoals promotie van condoomgebruik, herhaald testen, en effectievere (tijdige en complete) partnerwaarschuwing nodig blijven om de seksuele gezondheid van deze groep en van hun partners te verbeteren.
Auteurs
M. Visser, F. van Aar, E.L.M. Op de Coul, I.A.L. Slurink, D.A. van Wees, B.M. Hoenderboom, C. den Daas, P.J. Woestenberg, H.M. Götz, B.H.B. van Benthem, RIVM, Centrum Infectieziektebestrijding,
Correspondentie
Literatuur
- Van Sighem AI, Boender TS, Wit FWNM, Smit C, Matser A, Reiss P. Monitoring report 2017. Human Immunodeficiency Virus (HIV) Infection in the Netherlands. Amsterdam: Stichting HIV Monitoring, 2017. Beschikbaar online via www.hiv-monitoring.nl
Surveillance van STEC in Nederland in 2017
Shigatoxineproducerende Escherichia coli (STEC) is een bacterie die maag-darmklachten kan veroorzaken met symptomen variërend van diarree tot hemorragische colitis en het hemolytisch-uremisch syndroom (HUS).(1) STEC is een zoönose met herkauwers - vooral runderen - als belangrijkste reservoir. (2) STEC-infecties zijn vaak het gevolg van de consumptie van besmet voedsel, maar transmissie via het milieu lijkt ook belangrijk. (2, 3) Acute STEC-infecties zijn meldingsplichtig onder de Wet publieke gezondheid (Wpg), vanwege de ernst van de ziekte, vooral bij kleine kinderen en ouderen, en het risico op grootschalige uitbraken. In dit artikel presenteren we de resultaten van de surveillance voor het jaar 2017.
Surveillance van STEC in Nederland in 2017
Methoden
Sinds juli 2016 gelden de nieuwe meldingscriteria voor STEC. (4) Bij diagnostiek met behulp van een PCR-test (Polymerase Chain Reaction), waarbij het laboratorium onderscheid kan maken naar shigatoxine genen (stx1- en stx2-genen) en kan testen op EscV -of E. coli attaching-and-effacing genen (eae-gen), hoeven patiënten waarbij het stx1-gen wordt aangetoond alleen gemeld te worden als ook het EscV- of eae-gen aanwezig is, aangezien stx1 zonder deze genen niet geassocieerd is met ernstige ziekte; voor aanwezigheid van het stx2-gen geldt deze voorwaarde niet. In geval van kweek gelden geen extra voorwaarden. Verder is de meldingsplicht vernauwd tot acute infecties (maximaal 21 dagen tussen eerste ziektedag en afnamedatum) met in ieder geval diarree, braken en/of bloed in de ontlasting. De aparte, langere vragenlijst is in Osiris geïntegreerd, maar wordt alleen zichtbaar als de infectie in Nederland (of onbekend) is opgelopen. De meldingscriteria in het geval van STEC-HUS zijn niet gewijzigd.
Daarnaast kunnen de laboratoria STEC positieve E. coli-kolonies die voldoen aan de meldingscriteria, opsturen naar het RIVM. Op het RIVM worden alle ingestuurde STEC-isolaten met behulp van PCR getest op de aanwezigheid van de belangrijkste virulentiegenen (stx-genen, eae-gen en het EHEC-hemolysine gen (EHEC-hly-gen)). Als er virulentiegenen aangetoond kunnen worden, vindt vervolgens O-serotypering en H-typering plaats en wordt het isolaat ingestuurd voor whole-genome sequencing (WGS). De WGS-data worden vervolgens gebruikt voor clusterdetectie door middel van core-genome multi-locus sequence typing (CgMLST) en in silico analyses zoals serotypering (wordt momenteel gevalideerd met klassieke serotypering). De cgMLST-clusterdetectie vervangt de Pulsed Field Gel Electrophoresis analyse (PFGE) die sinds 2017 niet meer wordt uitgevoerd.
Bij een vermoeden van een bron uit levensmiddelen of landbouwhuisdieren wordt contact opgenomen met de Nederlandse Voedsel- en Warenautoriteit (NVWA) voor monstername van levensmiddelen en/of bemonstering van dierlijke bronnen of omgeving voor onderzoek naar STEC, en typering van eventuele isolaten. Daarnaast onderzoekt de NVWA jaarlijks in het kader van diverse monitoringsprojecten, relevante producten op de aanwezigheid van STEC en test gevonden stammen op aanwezige stx-genen, aanhechtingsgenen (eae, aggR+aaiC) en bepaalt het serotype. De methoden bij het onderzoek van de NVWA zijn gebaseerd op ISO-methode 13136 en de diverse typerings PCRs van het EURL-VTEC. De methode voor de detectie van stx2f is gebaseerd op Derzelle et al.(5)
Resultaten
Patiënten
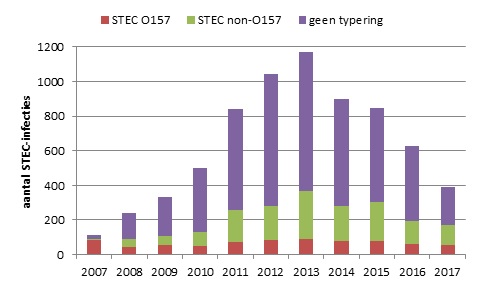
In 2017 zijn er conform de Wpg 393 patiënten met een STEC-infectie gemeld (Figuur 1). Van deze patiënten hadden 58 patiënten een bevestigde STEC O157-infectie en 114 een STEC non-O157-infectie. Van de overige patiënten kon het ingestuurde isolaat niet als STEC bevestigd worden (n=47) of was er geen isolaat ingestuurd (n=174). Iets meer vrouwen (59%) dan mannen hadden een STEC-infectie. HUS werd gemeld voor 12 patiënten, waarvan 4 kinderen (1-4 jaar) en 8 volwassenen (33-84 jaar), 67% was vrouw. Bij 5 HUS-patiënten was de O-typering bekend: 2x O157 (1 kind en 1 volwassene), O26 (kind), O183 (volwassene) en O niet-typeerbaar (volwassene). Twee volwassenen zijn overleden aan de STEC-infectie: een 81-jarige man en een 83-jarige vrouw, beiden met een niet-getypeerde STEC.
Figuur 1. Aantal STEC-infecties gemeld over de jaren 2007-2017, onderverdeeld naar STEC O157, non-O157, en O-typering niet bekend. Tot 2007 was alleen STEC O157 meldingsplichtig, in juli 2016 zijn de meldingscriteria aangescherpt
De meeste STEC O157-infecties werden in 2017 in de maanden juni tot en met augustus (60%) gezien. Minder sterk (41%) gold dit ook voor de STEC non-O157-infecties. De piek van de niet-getypeerde STEC-infecties lag meer in de maanden juli tot en met september (43%). De mediane leeftijd van de patiënten lag boven de 40 jaar (Tabel 1). De STEC O157-infecties waren gelijkmatig verdeeld over de leeftijden, terwijl STEC non-O157-infecties minder onder 30 tot 49 jarigen lijken voor te komen en de leeftijdspiek bij de niet-getypeerde STEC-infecties ligt bij de 60-plussers. Rond 95% van de patiënten werd gemeld met in ieder geval diarree. Bloed in de ontlasting en ziekenhuisopname werd vaker gemeld bij STEC O157-infecties dan bij de andere infecties, de overige symptomen werden ongeveer even vaak gemeld binnen de 3 groepen. In ongeveer 10% van de gevallen werd melding gemaakt van andere zieken in de omgeving van de patiënt, wat voornamelijk gezins-/huishoudcontacten waren.
Van de getypeerde STEC-infecties was 17-18% in het buitenland opgelopen (Tabel 1), bij de niet-getypeerde STEC-infecties was dit 28%. In Afrika werden met name STEC O157- en niet getypeerde infecties opgelopen, in Europa waren dat net iets vaker STEC non-O157-infecties.
Tabel 1. Kenmerken van STEC-infecties gemeld in 2017
| O157 | STEC non-O157 | Overig/niet getypeerd | |
| N | 58 | 114 | 221 |
| Mediane leeftijd (range) | 41,5 (2-89) | 40 (0-83) | 49 (1-95) |
| Geslacht - vrouw (%) | 37/58 (64) | 70/114 (61) | 126/221 (57) |
| Diarree (%) | 54/58 (93) | 107/113 (95 ) | 208/216 (96) |
| Bloed in ontlasting (%) | 45/58 (78) | 51/113 (45) | 89/216 (41) |
| Braken (%) | 11/58 (19) | 29/113 (26) | 58/216 (27) |
| Misselijk (%) | 21/58 (36) | 41/113 (36) | 78/216 (36) |
| Buikpijn (%) | 34/58 (59) | 61/113 (54) | 129/216 (60) |
| Buikkramp (%) | 31/58 (53) | 48/113 (42) | 82/216 (38) |
| Minder urineren (%) | 3/58 (5) | 3/113 (3) | 18/216 (8) |
| Koorts (%) | 11/58 (19) | 25/113 (22) | 61/216 (28) |
| Ziekenhuisopname (%) | 23/58 (40) | 24/112 (21) | 60/213 (28) |
| HUS (%) | 2/58 (3) | 3/113 (3) | 7/216 (3) |
| Overleden | 0 | 0 | 2 |
| Andere zieken in omgeving (%) | 4/52 (8) | 8/101 (8) | 18/189 (10) |
| eigen gezin/huishouden | 3 | 6 | 14 |
| overig | 1 | 2 | 4 |
| Buitenland (%) | 10/57 (18) | 19/109 (17) | 59/213 (28) |
| Afrika | 4 (40) | 6 (32) | 25 (42) |
| Azië | 2 (20) | 3 (16) | 14 (24) |
| Europa | 3 (30) | 8 (42) | 14 (24) |
| Overig | 1 (10) | 2 (11) | 6 (10) |
De extra vragen in Osiris hoeven alleen ingevuld te worden als de infectie in Nederland is opgelopen of als dat onbekend is. Bij 96%, 92% en 93% van respectievelijk de STEC O157-, STEC non-O157- en overige infecties die aan dit criterium voldoen werden 1 of meer van deze vragen ingevuld (Tabel 2). Vrijwel alle patiënten aten vlees (88-100%). Rauwe melk lijkt in 2017 vaker te zijn
gedronken door de groep STEC O157 patiënten (21%) dan door de andere 2 groepen (7%). Ook hadden de STEC O157-patiënten meer contact met huisdieren (72%) dan de andere 2 groepen (42-53%). Contact met landbouwhuisdieren (6-10%) en mest (5-15%) is minder gemeld. 13%, 20% en 32% van de respectievelijk STEC non-O157-, STEC O157- en overige patiënten gebruikte maagzuurremmers. Ook had 36% tot 56% van de patiënten onderliggend lijden.
Tabel 2. Voedselconsumptie, contact met dieren, medicijngebruik en onderliggend lijden gerapporteerd door STEC-patiënten die niet in buitenland zijn geweest, 2017
| O157 (%) | STEC non-O157 (%) | overig (%) | |
Gegevens beschikbaar | 45/47 (96) | 83/90 (92) | 143/154 (93) |
| Vleeseter | 40/40 (100) | 68/77 (88) | 120/133 (90) |
| biefstuk | 5/38 (13) | 15/68 (22) | 22/117 (19) |
| tartaar | 3/38 (8) | 7/68 (10) | 14/117 (12) |
| hamburger | 14/38 (37) | 18/68 (26) | 35/117 (30) |
| filet americain | 6/38 (16) | 8/68 (12) | 22/117 (19) |
| carpaccio | 5/38 (13) | 3/68 (4) | 6/117 (5) |
| rosbief | 2/38 (5) | 5/68 (7) | 13/117 (11) |
| ossenworst | 2/38 (5) | 2/68 (3) | 7/117 (6) |
| rauw.niet-gaar vlees | 13/38 (34) | 26/68 (38) | 46/117 (39) |
| Kiemgroenten | 5/39 (13) | 12/67 (18) | 13/116 (11) |
| Slasoorten | 30/39 (77) | 37/67 (55) | 68/116 (59) |
| Rauwe melk | 8/38 (21) | 5/67 (7) | 8/114 (7) |
| Rauwmelkse kaas | 4/38 (11) | 2/67 (3) | 7/114 (6) |
| Contact met dieren | 32/39 (82) | 35/72 (49) | 78/130 (60) |
| huisdieren | 28/39 (72) | 30/72 (42) | 68/129 (53) |
| landbouwhuisdieren | 4/39 (10) | 4/72 (6) | 11/129 (9) |
| Contact met mest | 6/41 (15) | 5/74 (7) | 6/132 (5) |
| Immunosuppresiva | 2/41 (5) | 3/78 (4) | 10/126 (8) |
| Maagzuurremmers | 8/41 (20) | 10/78 (13) | 40/126 (32) |
| Cholesterolverlagers | 5/41 (12) | 2/78 (3) | 11/126 (9) |
| Onderliggend lijden | 18/42 (43) | 27/75 (36) | 73/130 (56) |
Mogelijke bronnen van infectie
Naar aanleiding van een klacht en/of een vermoede voedselbron van infectie werden in 2017 in 6 gevallen voedselmonsters op STEC getest door de NVWA. In 1 van onderzochte monsters werd STEC aangetoond. Het was echter niet mogelijk om een match aan te tonen met de infectie, omdat er geen humaan isolaat beschikbaar was.
De NVWA onderzocht in 2017 in 23 monitoringsprojecten de aanwezigheid van STEC in voedsel, waarbij het zwaartepunt lag bij retailvleesprojecten. De hoogste prevalentie werd gevonden in vers vlees van kleine herkauwers: in 18 van de 196 monsters (9,2%) werd een STEC-isolaat gevonden (Tabel 3). Beperkte monitoring op retailleesbereidingsmonsters van kleine herkauwers (gehakt, gekruid, etc.) liet een nog hogere prevalentie zien, met 5 isolaten in 29 monsters (17,2%). In kalfsvlees was de prevalentie ook hoog: 16 isolaten werden gevonden in 236 monsters (6,8%). Interessant is dat in de monitoringsprojecten op visproducten, mosselen, oesters en levende tweekleppigen alleen in 1 monster levende tweekleppigen een isolaat gevonden werd. In de projecten met betrekking tot groenten en kruiden werden dit jaar enkel in rauw te consumeren groente 2 monsters positief bevonden.
Tabel 3. Aantal STEC-positieve en genomen monsters binnen NVWA-monitoringsprojecten, 2017
| positief/monsters | % | |
| vers vlees van kleine herkauwers | 18/196 | 9,2 |
| vleesbereidingsmonsters van kleine herkauwers | 5/29 | 17,2 |
| kalfsvlees | 16/236 | 6,8 |
| vlees voor rauwe consumptie | 4/281 | 1,4 |
| vers rundvlees | 6/273 | 2,2 |
| gehakt en vleesbereidingen | 3/265 | 1,1 |
| bewerkt pluimveevlees | 3/265 | 1,1 |
| vers pluimveevlees | 0/273 | 0 |
| import exotisch vlees | 2/46 | 4,3 |
| visproducten | 0/630 | 0 |
| mosselen | 0/63 | 0 |
| oesters | 0/28 | 0 |
| levende tweekleppigen | 1/229 | 0,4 |
Er werden in 2017 in voedsel in totaal 56 isolaten gevonden, met 31 verschillende O-groepen. Hierbij werd O146:H21 (n=8) het meest gevonden. Slecht 3 van deze isolaten waren positief voor het eae-gen, waaronder de 2 isolaten uit rauw te consumeren groente.
Naast de projecten gericht op voedsel werden ook mestmonsters (van vleeskalveren) onderzocht op aanwezigheid van STEC, waarbij STEC geïsoleerd werd bij 49 van de 196 geteste bedrijven (25,3%).
Er werden in totaal 54 specifieke isolaten verkregen. De serotypes O136:H12 (n=8) en O157:H7 (n=8) werden het meest gevonden. De O136:H12 isolaten waren allen eae-negatief, van de 8 O157:H7 isolaten waren 6 eae-positief.
Humane isolaten
Van 55 van de 58 STEC O157-patiënten was het isolaat beschikbaar, iets meer dan de helft bevatte beide stx-genen (53%), 46% bevatte alleen het stx2-gen en 1 isolaat (2%) bevatte alleen het stx1-gen (Tabel 4). Van de 107 beschikbare STEC non-O157-isolaten bevatten 42 (39%) isolaten alleen het stx1-gen, 47 (44%) isolaten alleen het stx2-gen en 18 (17%) isolaten bevatten beide genen. In totaal hadden de meeste isolaten (55%) het eae- en het EHEC-hly-gen. Binnen STEC non-O157 werd STEC O26 (n=33; 29%) het meest gevonden, op afstand gevolgd door STEC O103 (n=9; 8%) en STEC O146 (n=8; 7%). In totaal werden er 37 verschillende O-groepen gevonden, naast 7 niet-typeerbare en 3 auto-agglutinabele STEC’s. In de periode 2007-2017 waren O26 (n=211; 15%), O91 (n=140; 10%), O103 (n=102; 7%), O146 (n=100; 7%) en O63 (n=93; 7%), na O157 (n=760), de 5 meest gevonden O-groepen.
Tabel 4. Detectie van genen in de O157- en non-O157-isolaten, 2017
| O157 | non-O157 | |
| n | 55 | 107 |
| stx 1 | 1 (2%) | 42 (39%) |
| stx 2 | 25 (46%) | 47 (44%) |
| stx2f | 0 | 11 (10%) |
| stx1 en stx2 | 29 (54%) | 18 (17%) |
| eae | 0 | 13 (12%) |
| EHEC-hly | 0 | 15 (14%) |
| eae & EHEC-hly | 55 (100%) | 59 (55%) |
| geen van beide | 0 | 20 (19%) |
WGS-clusters
Bij alle beschikbare isolaten uit 2017 werd voor het eerst WGS gebruikt voor clusterdetectie. Binnen de STEC O157-isolaten werden 6 clusters gedetecteerd met 15 patiënten (2-3 patiënten per cluster). Bij 5 clusters lag er maximaal 16 dagen tussen eerste ziektedagen, bij het zesde cluster lagen er 2 maanden tussen, maar was er wel sprake van regionale clustering. Geografische clustering werd ook in 2 andere O157-clusters gezien. Verder valt op dat 5 van de 6 clusters uit alleen volwassenen bestaan. De vragenlijstgegevens leverden geen duidelijke bron voor de verschillende clusters op. Bij de 2 clusters van STEC O26 valt op dat bij het ene cluster de 3 betrokken volwassenen allemaal binnen 2 dagen van elkaar ziek waren geworden en dat zij alle 3 filet américain hadden gegeten. Bij het tweede cluster van 2 patiënten lagen er 24 dagen tussen de eerste ziektedagen met als enige overeenkomst het eten van biefstuk. De 2 clusters van STEC O146 (2-3 patiënten per cluster) hadden geen duidelijke link onderling en bij de 2 clusters van STEC O103 (2 patiënten per cluster) lagen de eerste ziektedagen 1 tot 2 maanden uit elkaar en was er 1 regionaal geclusterd. De enige link tussen de 2 patiënten met STEC O121 was een periode van maar 5 dagen tussen de eerste ziektedag. Het STEC O63-cluster tenslotte, was opvallend omdat hierin alle 7 patiënten met STEC O63 uit 2017 zaten. De tussenpozen tussen eerste ziektedag varieerde van 3 dagen tot 3 maanden, waarbij 4 patiënten uit dezelfde regio kwamen.
Discussie
2017 was het eerste volledige jaar na de invoering van de nieuwe meldingscriteria in juli 2016. Zoals verwacht door de aanscherping van de meldingscriteria, zette de daling van het aantal gemelde STEC-infecties door, met name het aantal meldingen van infecties zonder STEC-typering. De surveillance is nu beperkt tot de acute infecties. Die lenen zich het beste voor (preventieve) GGD-acties - advies en voorlichting - tegen verdere verspreiding. Deze acute infecties geven een beter beeld van eventuele verheffingen dan chronische en/of vage klachten waarbij een STEC wordt gevonden. De invoering van WGS voor alle STEC-isolaten is daarbij een extra, belangrijk, hulpmiddel voor het detecteren van clusters.
De typen STEC O26 en O103 werden, na STEC O157, het meest aangetroffen. Deze 3 O-typen geven een verhoogd risico op een ernstig verloop van de ziekte, inclusief HUS. (6-10) STEC O26 heeft, sinds STEC non-O157 is opgenomen in de surveillance in Nederland, elk jaar in de top 3 van meest voorkomende O-typen gestaan. Hoewel deze 2 non-O157 typen een belangrijk aandeel hebben, blijft STEC O157 veruit de belangrijkste, zowel in aantal als in ernst. Vooral bloed in de ontlasting en ziekenhuisopname worden vaker gezien bij STEC O157-infecties dan bij de andere infecties.
In voedsel- en mestmonsters werden voornamelijk O146:H21, O157:H7 en O136:H12 gevonden. STEC O157 bij mensen is tot nu toe in principe altijd H7 geweest (kan wel fenotypisch H- zijn, maar hier wordt niet (meer) op getest). Van de 8 patiënten met STEC O146-infecties waren er 5 O146:H21 en 3 O146:H28. In 2017 werd 1 infectie gemeld met een STEC O136, deze STEC droeg hetzelfde H-type als in de mestmonsters werd gevonden. Recent is een Nederlandse attributiestudie uitgevoerd met gegevens en isolaten van patiënten en runderen, schapen en geiten, varkens en pluimvee uit de surveillance van 2011 tot en met 2014. (2) Daaruit bleek dat ongeveer de helft van de infecties kan worden toegeschreven aan runderen als reservoir en de types O157, O26, O91 en O103 zelfs 61-75%. Ongeveer een kwart van de infecties kan worden toegeschreven aan schapen en geiten, en 71-77% van de infecties aan O146. Varkens en pluimvee zijn kleinere reservoirs van STEC.
Met de invoering van de nieuwe meldingscriteria is ook Osiris aangepast, waarbij de aparte, langere vragenlijst die voorheen werd afgenomen voor extra informatie over risicofactoren, is geïntegreerd en nieuwe vragen toegevoegd. Naar medicijngebruik en onderliggend lijden werd eerder niet in de aparte vragenlijst gevraagd. Vooral de patiënten met een infectie waarbij we het O-type niet weten, lijken vaker medicijnen te gebruiken en onderliggend lijden te hebben in vergelijking tot de respondenten in een controle-survey die sinds 2008 wordt uitgevoerd in de algemene bevolking. (11) In de periode 2008-2016, rapporteerde 13% (9-17% per jaar) en 2% (1-3% per jaar) van deze respondenten respectievelijk maagzuurremmers en immunosuppresiva te gebruiken en had 35% (30-40% per jaar) onderliggend lijden. Alleen het gebruik van cholesterolverlagers verschilt niet tussen STEC-patiënten en respondenten (16% (12-21%)).
De overstap van PFGE naar WGS voor clusterdetectie binnen de STEC O157-infecties heeft niet tot grote veranderingen geleid in de detectie van clusters. Het aantal clusters en de grootte van de clusters waren vergelijkbaar. Wel waren de WGS-resultaten sneller beschikbaar dan de PFGE-resultaten in de voorgaande jaren en konden de resultaten makkelijker met WGS-resultaten van andere instituten en landen vergeleken worden. PFGE werd niet toegepast op STEC non-O157 en ook voor deze groep was 2017 het eerste jaar waarover WGS-gegevens beschikbaar waren zodat ook voor STEC non-O157 clusterdetectie kon worden uitgevoerd. Sommige O-types clusterden sterk, bijvoorbeeld O63, terwijl anderen, bijvoorbeeld O26, een veel grotere spreiding lieten zien. Doordat historische data ontbreken is het, vooral bij lage aantallen isolaten, lastig te bepalen of het bij clustering binnen een O-type daadwerkelijk om een gezamenlijke bron gaat of om een stam die weinig evolueert. Een ander voordeel van WGS is dat hiermee ook het O- en H-type bepaald kan worden en groot aantal andere analyse in silico kan worden uitgevoerd (zoals additionele virulentiegenen en resistentiegenen). Momenteel wordt met de data van 2017 een validatie uitgevoerd van serologische en in silico serotypering en wordt binnenkort beslist of we volledig overgaan op in silico serotypering voor STEC waarbij de O- en H-typering in silico op basis van de WGS-resultaten wordt bepaald.
De focus van de STEC-surveillance ligt sinds juli 2016 op acute infecties. Door de invoering van de nieuwe meldingscriteria is het aantal meldingen gedaald, maar is de gemiddelde hoeveelheid (achtergrond)informatie over de patiënten gestegen. De focus op de meer voor de publieke gezondheid relevante infecties en meer informatie per gemelde patiënt, is een versterking van de surveillance. STEC O157 blijft de belangrijkste verwekker van STEC-infecties in Nederland, zowel in voorkomen als in ernst, gevolgd door STEC O26. In niet-humane isolaten werden voornamelijk STEC O146, O157 en O136 aangetroffen. De overstap naar WGS voor alle STEC-isolaten heeft de clusterdetectie binnen STEC O157 versneld en maakt het nu mogelijk om ook clusters binnen de STEC non-O157 tijdig te ontdekken.
Wij bedanken alle GGD'en en medisch microbiologische laboratoria hartelijk voor hun medewerking bij het verzamelen van de patiëntgegevens en het insturen van isolaten. Ook bedanken we de medewerkers van de NVWA voor het bemonsteren van en onderzoek naar landbouwhuisdieren en (verdacht) voedsel.
Auteurs
I.H.M. Friesema1, S. Kuiling1, M. van der Voort2, P.H. in ‘t Veld2, M.E.O.C. Heck1, E. Franz1
1. RIVM, Centrum Infectieziektebestrijding2. Nederlandse Voedsel- en Warenautoriteit (NVWA), Divisie Handhaving
Correspondentie
Literatuur
- Smith J.L., Fratamico P.M., Gunther N.W. Shiga Toxin-Producing Escherichia coli. Advances in applied microbiology 2014; 86: 145-97.
- Mughini-Gras L., van Pelt W., van der Voort M., Heck M., Friesema I., Franz E. Attribution of human infections with Shiga toxin-producing Escherichia coli (STEC) to livestock sources and identification of source-specific risk factors, The Netherlands (2010-2014). Zoonoses Public Health 2018; 65: e8-e22.
- Friesema I.H., Van De Kassteele J., De Jager C.M., Heuvelink A.E., Van Pelt W. Geographical association between livestock density and human Shiga toxin-producing Escherichia coli O157 infections. Epidemiol Infect 2011; 139: 1081-7.
- Friesema I.H.M., Kuiling S., van der Voort M., in 't Veld P.H., Heck M.E.O.C., Franz E. Surveillance van Shiga toxine-producerende Escherichia coli (STEC) in Nederland, 2016. Infectieziekte Bulletin 2017; 28: 228-35.
- Derzelle S., Grine A., Madic J., et al. A quantitative PCR assay for the detection and quantification of Shiga toxin-producing Escherichia coli (STEC) in minced beef and dairy products. International Journal of Food Microbiology 2011; 151: 44-51.
- Bruyand M., Mariani-Kurkdjian P., Gouali M., et al. Hemolytic uremic syndrome due to Shiga toxin-producing Escherichia coli infection. Medecine et maladies infectieuses 2018; 48: 167-74.
- Naseer U., Lobersli I., Hindrum M., Bruvik T., Brandal L.T. Virulence factors of Shiga toxin-producing Escherichia coli and the risk of developing haemolytic uraemic syndrome in Norway, 1992-2013. Eur J Clin Microbiol Infect Dis 2017; 36: 1613-20.
- Gould L.H., Mody R.K., Ong K.L., et al. Increased Recognition of Non-O157 Shiga Toxin-Producing Escherichia coli Infections in the United States During 2000-2010: Epidemiologic Features and Comparison with E. coli O157 Infections. Foodborne Pathog Dis 2013; 10: 453-60.
- Käppeli U., Hächler H., Giezendanner N., Beutin L., Stephan R. Human infections with non-O157 Shiga toxin-producing Escherichia coli, Switzerland, 2000-2009. Emerg Infect Dis 2011; 17: 180-5.
- Newell D.G., La Ragione R.M. Enterohaemorrhagic and other Shiga toxin-producing Escherichia coli (STEC): Where are we now regarding diagnostics and control strategies? Transbound Emerg Dis 2018: doi: 10.1111/tbed.12789.
- Friesema I.H.M., van Gageldonk-Lafeber A.B., Van Pelt W. Extension of traditional infectious disease surveillance with a repeated population survey Eur J Public Health 2015; 25: 130-4.
Infectieziekten Bulletin, Jaargang 29, editie 8 (oktober).
Hoe groot is de kans op rabiës na een beet van een knaagdier?
Nog steeds krijgt de LCI (Landelijke Coördinatie Infectieziektebestrijdig van het RIVM)veel vragen over rabiës. Deze vraag gaat over reizigers die in risicolanden voor rabiës door een knaagdier zijn gebeten. Voorbeelden zijn nachtelijke beten door ratten op Bali, de Filipijnen, Sint Maarten, beten van tamme ratten en eekhoorns in Indonesië, Thailand en de Grand Canyon. Muizenbeten op diverse plekken in de wereld. Voortdurend is daarbij de vraag, hoe groot is het risico op rabiës?
Hoe groot is de kans op rabiës na een beet van een knaagdier?
Wat is rabiës?
Rabiës (hondsdolheid) is een infectieziekte die wordt veroorzaakt door een virus dat de hersenen infecteert. Mensen kunnen besmet raken via een beet, krab of lik van een geïnfecteerd dier. Wanneer rabiës bij mensen niet wordt behandeld is het vrijwel altijd dodelijk. In Nederland komt de ziekte zeer zelden voor, en alleen bij bepaalde soorten vleermuizen. De laatste in Nederland gemelde patiënten met rabiës waren besmet in het buitenland. Reizigers in gebieden waar rabiës voorkomt lopen wel een risico op besmetting als zij in contact komen met bepaalde diersoorten via een beet, krab of lik.
Nieuw beleid
Op basis van een uitgebreide systematische literatuurstudie naar rabiës heeft de World Health Organization (WHO) aanbevelingen gedaan die in 2018 hebben geleid tot aanpassing van de LCI-rabiësrichtlijn. De volgende informatie is toegevoegd: Er zijn tot op heden geen bevestigde casussen beschreven van humane rabiës veroorzaakt door knaagdieren, lagomorfen (konijnen en hazen) of spitsmuizen. Hieruit kan geconcludeerd worden dat vaccinatie en/of rabiësimmunoglobinen (RIG) na een beet, krab of lik door een van deze dieren niet wordt geadviseerd. Alhoewel dit advies wordt onderschreven door de WHO zijn er landen die dit advies niet opvolgen, bijvoorbeeld het Verenigd Koninkrijk waar na een beet, krab of lik van knaagdieren wel gestart wordt met actieve immunisatie.
Twee kanttekeningen
Bij de beoordeling van incidenten met knaagdieren is het wel heel belangrijk om zorgvuldig na te gaan of het dier in kwestie echt gezien is of dat het om een vermoeden gaat. Bekend zijn bijvoorbeeld nachtelijke verwondingen in tropen of subtropen zonder dat het dier is gezien. En, als het dier wel is gezien, was het dan wel een knaagdier?
Wat is een knaagdier?
Knaagdieren vormen de soortrijkste orde binnen de zoogdieren: bijna 40% van alle zoogdiersoorten behoort tot deze familie. Knaagdieren komen, met uitzondering van Antarctica, voor op alle continenten in diverse leefgebieden, in bomen, onder de grond en in (zoet) water. Over het algemeen zijn knaagdieren vrij klein. Het grootste knaagdier is de capibara uit Zuid-Amerika, die minstens 40 kilogram kan wegen. Het belangrijkste kenmerk van knaagdieren is hun bijzondere gebit. Zij bezitten 4 grote, scherpe snijtanden, 2 in de bovenkaak en 2 daar tegenover in de onderkaak.
Antwoord
Een knaagdierbeet is geen indicatie voor postexpositieprofylaxe of actieve immunisatie. Wel is het van belang om goed na te gaan of er werkelijk sprake was van een incident met een knaagdier. Bij twijfel blijft het zinvol om te overleggen met de LCI.
Auteurs
T. Oomen, RIVM, Centrum Infectieziektebestrijding
Correspondentie
Bronnen:
- RIVM website en LCI richtlijn Rabiës
- WHO-SAGE richtlijn: http://apps.who.int/iris/bitstream/handle/10665/272364/9789241210218-eng.pdf?sequence=1&isAllowed=yn
- WHO Weekly Epidemiological Record april 2018: https://www.who.int/wer/2018/wer9316/en/
Aankondigingen
Webinars over infectieziekten
Het Centrum Epidemiologie en Surveillance van Infectieziekten van het RIVM organiseert 1x per 2 weken op donderdag van half 1 tot half 2 een refereerbijeenkomst, waarin 2 onderzoekers hun onderzoeksresultaten bespreken en bediscussiëren. De onderzoeken hebben betrekking op surveillance en verdiepend onderzoek naar infectieziekten, dat binnen het centrum wordt uitgevoerd.
Sinds een jaar is deze refereerbijeenkomst ook via een webinar online te volgen. Hiervoor moet je je van tevoren aanmelden. Wil je op de hoogte blijven van de onderwerpen die aan bod komen, stuur dan een email naar EPIrefereer@rivm.nl.
We sturen je dan een uitnodiging voor alle refereerbijeenkomsten, zodat deze in je agenda komen. Verder ontvang je dan een aantal dagen voor de refereerbijeenkomst meer informatie over de onderwerpen die besproken worden en details over het aanmelden voor de webinar.
Deel deze informatie vooral met collega's die mogelijk ook belangstelling hebben.
Registratie infectieziekten
Wet publieke gezondheid
Virologische weekstaten
Meldingen in de virologische weekstaten tot en met week 40, 2018