Surveillance van mogelijke bijwerkingen na HPV-vaccinatie: het vaccin is veilig

Sinds 2009 wordt in Nederland vaccinatie aangeboden tegen infectie met het human papillomavirus (HPV) ter preventie van (voorloper stadia van) baarmoederhalskanker. Jaarlijks krijgen ongeveer 700 vrouwen baarmoederhalskanker en sterven hieraan ongeveer 200 vrouwen. De afgelopen jaren is informatie beschikbaar gekomen dat HPV ook andere vormen van kanker kan veroorzaken zoals kanker van de vagina, vulva, penis, anus en mond/keel. Continue surveillance van gemelde bijwerkingen die optreden na vaccinatie wordt uitgevoerd aan de hand van een spontaan meldsysteem. Daarnaast is na de invoering van HPV-vaccinatie actief onderzoek gedaan naar klachten/symptomen die optraden in de week ná HPV-vaccinatie. Ook zijn deze vergeleken met het voorkomen van systemische klachten/symptomen in de periode vóór vaccinatie.
In 2009 is er gestart met een catch-up vaccinatiecampagne voor meisjes geboren in 1993-1996 (13 t/m 16 jaar) en vanaf 2010 wordt HPV-vaccinatie via het Rijksvaccinatieprogramma (RVP) aangeboden aan 12/13-jarige meisjes (geboren vanaf 1997). (1) In eerste instantie bestond de HPV-vaccinatie uit een 3-dosesschema op 0, 1 en 6 maanden. Vanaf 2014 wordt een 2-dosesschema (0 en 6 maanden) aangeboden voor meisjes die voor hun 15e verjaardag starten met de vaccinatie. Tot op heden wordt het bivalente HPV-vaccin gebruikt dat gericht is tegen HPV-typen 16 en 18, die samen ongeveer 70% van de baarmoederhalskankers veroorzaken. Wereldwijd is het HPV-vaccinatie ingevoerd in 80 landen. (2)
De vaccineffectiviteit van de HPV-vaccins is hoog. In Nederlands onderzoek werd een vaccineffectiviteit gevonden van het bivalente vaccin van 95% tegen persisterende HPV16/18-infecties tot in ieder geval 7 jaar na vaccinatie. Ook werd significante kruisbescherming gevonden tegen HPV31/45 (75%). (2, 3) Onder vrouwen die een soakliniek bezochten is de HPV16/18-prevalentie gedaald van 23% voor introductie van vaccinatie naar 15% in 2015. Ook onder heteroseksuele mannen is dit gedaald van 17% naar 11%. (4)In tegenstelling tot andere vaccinaties in het RVP, waarbij de vaccinatiegraad 90% of hoger is, laat slechts ongeveer de helft van de meisjes zich vaccineren tegen HPV. Tijdens de catch-up campagne liet 52% van de opgeroepen meisjes zich vaccineren. De vaccinatiegraad van het reguliere programma steeg van 56% in 2010 naar 61% in 2013/2014, maar daalde daarna naar 54% in 2015 en 45% in 2016. (5) De belangrijkste reden die ouders gaven om hun dochters niet tegen HPV te laten vaccineren of daarover te twijfelen, zijn zorgen over mogelijke bijwerkingen van het HPV-vaccin. (5)
In de afgelopen jaren is er regelmatig media-aandacht geweest rondom de veiligheid van HPV-vaccinatie. Zo waren er zorgen over mogelijke bijwerkingen als posturaal orthostatisch tachycardie syndroom (POTS), complex regionaal pijnsyndroom (CRPS) en chronisch vermoeidheidssyndroom (CVS). Na een review concludeerde de European Medicines Agency (EMA) in november 2015 dat er geen bewijs is dat HPV-vaccins POTS of CRPS kunnen veroorzaken. (6) Onderzoek in Engeland en Noorwegen toonden geen verhoogd risico op vermoeidheidssyndromen voor gevaccineerde meisjes. (7-9)
In Nederland vindt continue surveillance plaats naar klachten/symptomen die optreden na vaccinatie en wordt nader onderzocht of deze klachten/symptomen mogelijk geassocieerd zijn met vaccinatie. Mede naar aanleiding van nationale en internationale media-aandacht en de review van de EMA heeft het Bijwerkingencentrum Lareb in Nederland meer meldingen ontvangen. Nadere analyse is gedaan op basis van meldingen van mogelijke langdurige bijwerkingen van het HPV-vaccin en er zijn aanvullende onderzoeken uitgevoerd. In dit artikel worden de resultaten beschreven van de surveillance en studies naar mogelijke bijwerkingen van het HPV-vaccin. De resultaten zijn eerder gepubliceerd. (10-18) Het veiligheidsprofiel is in overeenstemming met buitenlands onderzoek waarbij milde voorbijgaande klachten/symptomen zoals pijn rond de prikplaats, spierpijn, hoofdpijn en moeheid regelmatig voorkomen. (16-18) Er zijn geen aanwijzingen zijn voor associatie van het HPV-vaccin met langdurige bijwerkingen. (6-9, 14, 15)
Methoden
Continue surveillance van de veiligheid van vaccinaties wordt uitgevoerd door middel van een spontaan meldsysteem voor mogelijke bijwerkingen. Hiermee wordt de veiligheid van vaccins en de mogelijke bijwerkingen die na vaccinatie optreden bewaakt, waardoor tijdig actie ondernomen kan worden indien nodig. Dit spontane meldsysteem werd tot 2011 beheerd door het Rijksinstituut voor Volksgezondheid en Milieu (RIVM) en vanaf 2011 door Bijwerkingencentrum Lareb. Na deze overgang is door Lareb een campagne gestart onder ouders van gevaccineerde kinderen om melding van mogelijke bijwerkingen te promoten. Het gaat hierbij om klachten/symptomen die zijn opgetreden na vaccinatie of waarvan het vermoeden is dat het een bijwerking betreft, er hoeft dus geen sprake te zijn van een oorzakelijk verband met het vaccin. Beoordeling van meldingen vindt plaats op individuele basis, waarbij een beroep kan worden gedaan op medisch specialisten. Signalering van nieuwe (onbekende) mogelijke bijwerkingen, een nieuw aspect van een bekende bijwerking of een toename in het aantal meldingen van bepaalde klachten/symptomen die optreden na de vaccinatie vindt hierbij plaats. In het geval van een signalering wordt deze gerapporteerd aan het RIVM en het College ter Beoordeling van Geneesmiddelen (CBG). Het Centrum voor Infectieziektebestrijding (CIb) van het RIVM heeft aanvullend onderzoek uitgevoerd naar migraine en naar langdurige vermoeidheid. (14, 15)
Daarnaast is bij de introductie van HPV-vaccin (2009 en 2010) en bij de wijziging naar een 2-dosesschema (2014) in de doelgroep vragenlijstonderzoek naar de tolerabiliteit (i.e. verdraagbaarheid) uitgevoerd. (13,16-18) Dit betreft een onlinevragenlijst waarin gevraagd wordt naar het optreden van lokale en systemische klachten/symptomen in de 7 dagen na vaccinatie. In aanvulling hierop is er ten tijde van de introductie van HPV-vaccinatie (2009 en 2010) een vragenlijst tijdens de vaccinatiesessies verspreid om direct optredende klachten/symptomen te monitoren.
Resultaten
Direct optredende klachten/symptomen tijdens de vaccinatiesessies en tolerabiliteit van het HPV-vaccin
Monitoring van direct optredende klachten/symptomen tijdens de vaccinatiesessies heeft plaatsgevonden in 2009 en 2010 met behulp van een vragenlijst die tijdens de vaccinatiesessies is verspreid. Hieruit bleek dat directe klachten/symptomen tijdens de vaccinatiesessies vaker optraden tijdens de catch-up campagne in 2009 dan tijdens de reguliere campagne in 2010 (27,1 versus 7,7 per 10.000 doses). (16,18) De meest gerapporteerde direct optredende klacht was (bijna) flauwvallen, dit werd 688 keer gerapporteerd in 2009 (16,8 per 100.000 doses) en 97 keer in 2010 (5,8 per 100.000 doses).
Tijdens de catch-up campagne en tijdens de reguliere campagnes van 2010 en 2014 namen in totaal 4248, 4501 (42%) en 566 (9%) meisjes deel aan vragenlijstonderzoek naar het optreden van klachten/symptomen in de week na de vaccinatie.
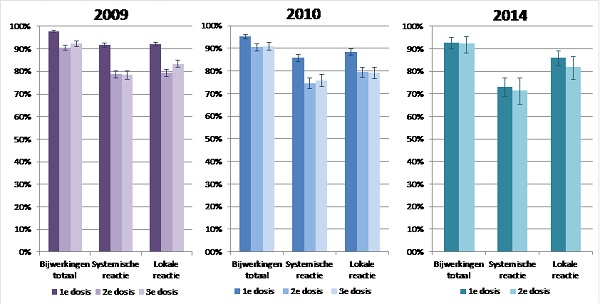
Van deze meisjes rapporteerde meer dan 90% een reactie in de week na de 3 opeenvolgende doses (figuur 1) (16-18). In 2014 was de tolerabiliteit van de eerste dosis gunstiger dan van de eerste dosis in 2009 en 2010. Voor de tweede dosis was de tolerabiliteit vergelijkbaar in alle jaren. (13)
Pijn rond de prikplaats en verminderd gebruik van de arm waren de meest gerapporteerde lokale reacties (respectievelijk 70-84% en 48-72%), waarvan 10-30% werd geclassificeerd als ‘veel’. Zwelling en roodheid werden gerapporteerd door 10-20% en 8-15% van de meisjes. Spierpijn was de meest gerapporteerde systemische reactie (55-75%). Ook werden moeheid en hoofdpijn regelmatig gerapporteerd (respectievelijk 19-34% en 18-30%). (16-18)
Tijdens de catch-up campagne rapporteerden oudere meisjes (cohort 1993-1995) vaker pijn rond de prikplaats, moeheid en hoofdpijn dan jongere meisjes (cohort 1996). (16) Andere gerapporteerde systemische reacties waren verkoudheid (10-23%), lusteloosheid (10-20%), buikpijn (10-18%), duizeligheid (6-20%), misselijkheid (7-16%), slaapproblemen (6-14%), gewrichtspijn (4-13%), hoesten (4-12%), spiertrekkingen (2-12%), jeuk (3-10%), benauwdheid (3-8%), diarree (3-5%), huiduitslag (3-6%), huilen (3-4%), meer transpireren (2-5%), koorts (38°C; 2-4%), overgeven (1-2%) en flauwvallen (0-1%).
Er werden geen ernstige of onverwachte klachten/symptomen gerapporteerd. Ten tijde van de derde dosis in 2010 en voor beide doses in 2014 is een aanvullende vragenlijst onder de deelneemsters afgenomen waarin gevraagd is naar het voorkomen van klachten/symptomen in de week vóór de vaccinatie (n≈350 per ronde). Hieruit bleek dat systemische symptomen zoals hoofdpijn en moeheid even vaak of soms zelfs vaker voorkwamen in de week vóór de vaccinatie dan in de week erna (hoofdpijn 28-36% versus 17-26%; moeheid 20-43% versus 18-29%).
Figuur 1. Tolerabiliteit van het HPV-vaccin in meisjes gevaccineerd in 2009 (catch-up campagne), 2010 (reguliere campagne, 3-doses schema) en 2014 (2-doses schema)
Spontane meldingen van mogelijke bijwerkingen na HPV-vaccinatie
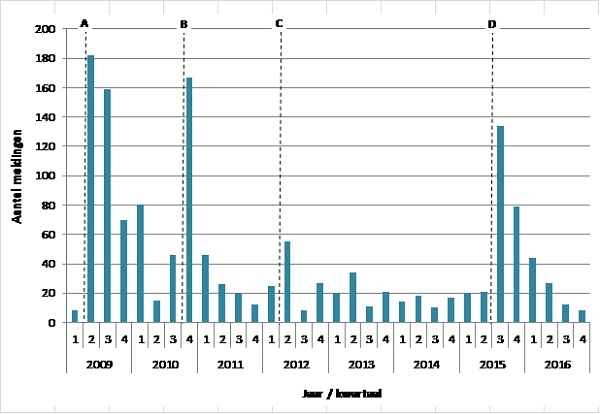
Tussen 1-1-2009 en 31-10-2016 zijn er 1436 spontane meldingen van mogelijke bijwerkingen van het HPV-vaccin ontvangen (figuur 2). (12) In totaal zijn er ruim 1,7 miljoen doses toegediend in 2009 t/m 2016. Hoofdpijn werd het vaakst gemeld (n=562). Meisjes die tijdens de catch-up campagne zijn gevaccineerd meldde vaker klachten/symptomen dan meisjes die gevaccineerd zijn tijdens het reguliere programma.
Van het totaal aantal spontane meldingen werden 346 geclassificeerd als langdurig (duur 2 maanden of langer), die in totaal 1167 langdurige klachten/symptomen bevatten (1 melding kan meerdere klachten/symptomen omvatten). (12) De meest gerapporteerde langdurige klachten/symptomen waren moeheid (>70% van de meldingen) en hoofdpijn (>50% van de meldingen). De meeste meldingen van langdurige klachten/symptomen werden ontvangen in het derde kwartaal van 2015, waarschijnlijk naar aanleiding van verhoogde media aandacht in deze tijd. (12) Deze meldingen zijn nagenoeg gelijk verdeeld over de verschillende geboortecohorten die voor HPV-vaccinatie in aanmerking kwamen (4-8 per 10.000 gevaccineerde meisjes).
Op basis van een analyse van de meldingen na HPV-vaccinatie in 2015 en 2016 kon een verband tussen langdurige vermoeidheid en de HPV-vaccinatie, noch worden uitgesloten noch worden aangetoond. (10, 11) In geen van de meldingen is de diagnose POTS of CRPS gesteld. Ook in de meldingen die 1 of meerdere symptomen bevatten die kunnen wijzen op POTS of CRPS zijn geen indicaties voor deze diagnoses gevonden.aangetoond. (10, 11) In geen van de meldingen is de diagnose POTS of CRPS gesteld. Ook in de meldingen die 1 of meerdere symptomen bevatten die kunnen wijzen op POTS of CRPS zijn geen indicaties voor deze diagnoses gevonden.
Figuur 2. Aantal meldingen van mogelijke bijwerkingen na HPV-vaccinatie per kwartaal, 2009-2016
A: Introductie van HPV-vaccinatie gepaard gaande met media-aandacht voor nieuwe mogelijke bijwerkingen
B: Overgang van rapportage van het RIVM naar Lareb, overige meldingen werden ingevoerd in de database
C: Op 20-3-2012 verscheen een artikel over mogelijke bijwerkingen na HPV-vaccinatie in De Telegraaf
D: Op 29-7-2015 kondigde Lareb aanvullend onderzoek naar mogelijke langdurige bijwerkingen geassocieerd met het HPV-vaccin aan op de radio
Onderzoek naar aanleiding van signalering van mogelijke bijwerkingen van het HPV-vaccin
Een regelmatig gemelde mogelijke bijwerking in het spontane meldsysteem sinds de introductie van HPV-vaccinatie was migraine. Dit gaf aanleiding voor onderzoek naar de mogelijke associatie tussen migraine en HPV-vaccinatie. (14) Voor dit onderzoek werden migrainecasussen geselecteerd uit het huisartsenregistratiesysteem van het Erasmus MC (IPCI) en gekoppeld aan HPV-vaccinatiegegevens uit het vaccinatieregistratiesysteem Praeventis van het RIVM. Uit de resultaten bleek dat migraine onder 12-16-jarige meisjes iets vaker voorkwam in de periode na introductie van vaccinatie vergeleken met de periode vóór introductie van vaccinatie (incidentie rate ratio (IRR): 1,14 (95% BI 0,82–1,62)), maar ditzelfde was ook het geval voor jongens die niet zijn gevaccineerd (IRR 1,21 (95% BI 0,77–1,97)). Migraine kwam niet vaker voor in gevaccineerde meisjes vergeleken met ongevaccineerde meisjes (11/1306 versus 11/699). Ook was het risico op het ontstaan van migraine in de 6 weken na vaccinatie niet statistisch significant hoger dan in andere perioden (RR 4,3; 95% CI 0,69-26,6), maar het aantal meisjes in deze analyse was klein. Op basis van deze analyses zijn geen aanwijzingen gevonden voor een mogelijke associatie tussen migraine en HPV-vaccinatie. (14)
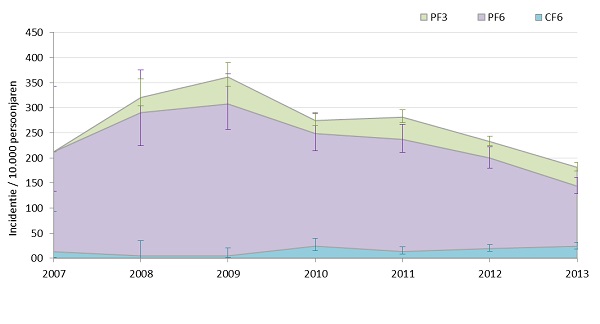
Ofschoon buitenlands onderzoek geen verhoogd risico op vermoeidheidssyndromen voor gevaccineerde meisjes toont (7-9), is in Nederland aanvullend onderzoek gedaan naar aanleiding van spontane meldingen van langdurige vermoeidheid na HPV-vaccinatie. (15) Voor deze retrospectieve cohort studie werd van bijna 70.000 meisjes van 12-16 jaar oud de huisartsenregistratiegegevens (IPCI/Erasmus MC) doorzocht op het voorkomen van vermoeidheidsklachten. Hieruit bleek dat vermoeidheidsklachten gedurende langer dan 3 maanden regelmatig voorkwam in deze leeftijdsgroep (figuur 3). Chronisch vermoeidheidssyndroom (CVS) werd zelden gediagnostiseerd. De incidenties van CVS, vermoeidheidsklachten 3-6 maanden en vermoeidheidsklachten langer dan 6 maanden onder 12-16-jarige meisjes waren niet statistisch significant hoger in de periode na de vaccinatie ten opzichte van meisjes van dezelfde leeftijd voor invoering van HPV-vaccinatie (CVS: 3,6 (95% BI 0,5–25,7)/10.000 geobserveerde patiëntjaren en 0,9 (0,4–2,1); vermoeidheid 3–6 maanden: 0,0 en 16,6 (13,6–20,3); vermoeidheid >=6 maanden: 7,3 (1,8–29,0) en 19,4 (16,1–23,4), respectievelijk voor en na vaccinatie). Meisjes met vermoeidheid langer dan 6 maanden werden om toestemming gevraagd om deze gegevens te koppelen aan hun HPV-vaccinatiegegevens (Praeventis/RIVM). Een beperkt aantal meisjes (n=16) gaf toestemming. Analyse van deze gegevens gaf geen aanwijzing voor een verhoogd risico op het ontstaan van langdurige vermoeidheid in het jaar na de vaccinatie (leeftijd-gecorrigeerde RR: 0,62; 95% CI 0.07-5.49) (15). Deze analyse zijn de resultaten zijn in lijn met uitkomsten van eerdere internationale onderzoeken. (7, 8)
Figuur 3. Incidentie van langdurige vermoeidheid in 12-16-jarige meisjes
CF6 = vermoeidheidsklachten zeker 6 maanden of langer
PF6 = vermoeidheidsklachten zeker of mogelijk 6 maanden of langer
PF3 = vermoeidheidsklachten zeker of mogelijk 3 maanden of langer
Conclusie
Uit surveillance en studies blijkt dat kortdurende lokale en systemische klachten/symptomen van voorbijgaande aard, zoals pijn in de arm en spierpijn, regelmatig gerapporteerd worden na vaccinatie. Systemische klachten/symptomen zoals hoofdpijn en moeheid werden echter net zo vaak gerapporteerd in de week vóór vaccinatie. Gericht onderzoek zowel nationaal toont geen aanwijzing naar een mogelijke associatie tussen langdurige bijwerkingen en het HPV-vaccin. Deze resultaten komen overeen met de uitkomsten van eerder verschenen internationale onderzoeken en bevestigen de veiligheid van het HPV-vaccin. Ondanks programmatische aanbieding van een vaccin tegen hoog risico typen HPV dat baarmoederhalskanker en andere HPV-gerelateerde kankers veroorzaakt, laat ongeveer de helft van de meisjes die in aanmerking komen voor deze vaccinatie zich niet vaccineren, voornamelijk uit angst voor mogelijke bijwerkingen. Hogere deelname aan HPV-vaccinatieprogramma kan door hoge effectiviteit van het HPV16/18-vaccin (2-4) aanzienlijke gezondheidswinst geven door vermindering van (voorloper stadia van) baarmoederhalskanker en sterfte hieraan.
Auteurs
T.M. Schurink-van t Klooster (1), J.M. Kemmeren (1), W.J.A. Hilgersom (3), J. Hoes (1,2), H.E. de Melker (1)
1. Centrum voor Infectieziekten bestrijding (CIb), RIVM, Bilthoven2. Afdeling Epidemiologie en Biostatistiek, Amsterdam UMC, locatie VUmc, Amsterdam3. Bijwerkingencentrum Lareb, 's-Hertogenbosch
Correspondentie
Literatuur
- Gezondheidsraad. Vaccinatie tegen baarmoederhalskanker. 2008.
- Schurink-van 't Klooster T, de Melker H. The National Immunisation Programme in the Netherlands: Surveillance and developments in 2017-2018. RIVM; 2018. Report No.: Rapport nr. 2019-0124.
- Donken R, King AJ, Bogaards JA, Woestenberg PJ, Meijer C, de Melker HE. High Effectiveness of the Bivalent Human Papillomavirus (HPV) Vaccine Against Incident and Persistent HPV Infections up to 6 Years After Vaccination in Young Dutch Women. The Journal of infectious diseases. 2018;217(10):1579-89.
- Woestenberg PJ, Bogaards JA, King AJ, Leussink S, van der Sande MA, Hoebe CJ, et al. Assessment of herd effects among women and heterosexual men after girls-only HPV16/18 vaccination in the Netherlands: A repeated cross-sectional study. International journal of cancer. 2018.
- van Lier EA, Geraedts JLE, Oomen PJ, Giesbers H, van Vliet JA, Drijfhout IH, et al. Vaccinatiegraad en jaarverslag Rijksvaccinatieprogramma Nederland 2017. RIVM; 2018. Report No.: Rapport nr. 2018-0008.
- European Medicines Agency (EMA). HPV vaccines: EMA confirms evidence does not support that they cause CRPS or POTS. 2016.
- Donegan K, Beau-Lejdstrom R, King B, Seabroke S, Thomson A, Bryan P. Bivalent human papillomavirus vaccine and the risk of fatigue syndromes in girls in the UK. Vaccine. 2013;31(43):4961-7.
- Feiring B, Laake I, Bakken IJ, Greve-Isdahl M, Wyller VB, Haberg SE, et al. HPV vaccination and risk of chronic fatigue syndrome/myalgic encephalomyelitis: A nationwide register-based study from Norway. Vaccine. 2017;35(33):4203-12.
- Medicines and Healthcare products Regulatory Agency (MHRA). Cervarix HPV vaccine: update on UK safety experience at end of 4 years use in the HPV routine immunisation programme. 2012.
- Bijwerkingencentrum Lareb. Analyse van meldingen na HPV-vaccinatie (Cervarix®). 2015.
- Bijwerkingencentrum Lareb. Long-lasting adverse events following immunization with Cervarix®. 2015.
- Bijwerkingencentrum Lareb. Long-lasting adverse events following immunization with Cervarix®: Update 2016. Bijwerkingencentrum Lareb; 2016.
- Schurink-van 't Klooster T, de Melker HE. The National Immunisation Programme in the Netherlands: Surveillance and developments in 2014-2015. RIVM; 2015. Report No.: Rapport nr. 2015-0134.
- Schurink-Van't Klooster TM, de Ridder MA, Kemmeren JM, van der Lei J, Dekker F, Sturkenboom M, et al. Examining a possible association between human papilloma virus (HPV) vaccination and migraine: results of a cohort study in the Netherlands. European journal of pediatrics. 2015;174(5):641-9.
- Schurink-Van't Klooster TM, Kemmeren JM, van der Maas NAT, van de Putte EM, Ter Wolbeek M, Nijhof SL, et al. No evidence found for an increased risk of long-term fatigue following human papillomavirus vaccination of adolescent girls. Vaccine. 2018;36(45):6796-802.
- van ’t Klooster T, Kemmeren J, Vermeer-de Bondt P, Oostvogels B, Phaff T, de Melker H, et al. Human papillomavirus vaccination catch-up campaign in 2009 for girls born in 1993 to 1996 in the Netherlands: Results of the post-marketing safety surveillance. RIVM; 2011. Report No.: Rapport nr. 210012001/2011.
- van Klooster TM, Kemmeren JM, van der Maas NA, de Melker HE. Reported adverse events in girls aged 13-16 years after vaccination with the human papillomavirus (HPV)-16/18 vaccine in the Netherlands. Vaccine. 2011;29(28):4601-7.
- van 't Klooster T, Kemmeren J, Vermeer-de Bondt P, Oostvogels B, Phaff T, de Melker H, et al. Adverse events following vaccination against human papillomavirus: Results of the 2010 campaign in the Netherland. RIVM; 2011. Report No.: Rapport nr. 210012002/2011.
Infectieziekten Bulletin, jaargang 30, themanummer Vaccinaties, nummer 3, april 2019