Surveillance en monitoring van Salmonella bij de mens, landbouwhuisdieren en in voedsel in Nederland, 2019
Na een jarenlange continu dalende trend in Nederland van Salmonella-infecties bij de mens is het aantal sinds 2013 gestabiliseerd op ruim 1500 laboratoriumbevestigde patiënten per jaar met een geschatte 26.000 patiënten in de gehele bevolking. Deze stabilisatie komt overeen met het beeld dat wordt gezien in de monitoring van landbouwhuisdieren en levensmiddelen. Opvallend in 2019 was de stijging in humane gevallen met S. Enteritidis-infecties (meestal gerelateerd aan eieren) en de daling van infecties met S. Typhimurium (meestal gerelateerd aan varkensvlees). Tevens is vanaf 2012 een significante stijging te zien van het aandeel invasieve infecties ten opzichte van het totaal aantal infecties door Salmonella. Alhoewel er in 2019 6 clusters werden gedetecteerd, was het een relatief rustig jaar wat betreft uitbraken (de laatste grote uitbraak dateert van 2016/2017 met S. Enteritidis in Poolse eieren). Whole genome sequencing (WGS) speelt een steeds belangrijkere rol in de surveillance bij het aantonen van clusters en het relateren van bronnen aan uitbraken. Alhoewel redelijk stabiel, is de resistentie tegen fluoroquinolonen nog steeds een zorg, evenals multiresistentie en ESBL(Extended Spectrum Beta Lactamases)-producerende Salmonella-isolaten.
Salmonellose is een van de meest voorkomende voedselinfecties in de Europese Unie (EU) en Nederland. Infecties met (non-typhoidale) Salmonella kunnen leiden tot gastro-enteritis met buikpijn, diarree en bloed bij de ontlasting. Soms kan een infectie gepaard gaan met een griepachtig ziektebeeld en leiden tot invasieve infecties (<5%). Antibioticabehandeling wordt alleen geadviseerd bij patiënten met een verhoogd risico op complicaties en in geval van invasieve infecties (sepsis, bacteriëmie). Vrijwel alle Salmonella-infecties bij mensen worden veroorzaakt door Salmonella enterica subspecies enterica. Hierbinnen wordt onderverdeling gemaakt in serovars op basis van verschillen in O- en H-antigenen, en meestal wordt alleen het serovar als naam gebruikt, zoals S. Typhimurium (= Salmonella enterica subsp. enterica serovar Typhimurium).
Veel dieren, inclusief landbouwhuisdieren, vormen een reservoir voor Salmonella-typen die relevant zijn voor de mens. In het algemeen zijn leghennen en varkens de belangrijkste bronnen, gevolgd door vleeskuikens en runderen (1). De relatieve bijdrage van deze reservoirs aan de besmetting van mensen verschilt per serovar (bijvoorbeeld Enteritidis is vooral gerelateerd aan leghennen, Typhimurium aan varkens, en Dublin aan runderen) en over de tijd. Deze dieren zijn vaak asymptomatische dragers maar infectie kan ook tot diarree of invasieve infecties leiden (bijvoorbeeld. S. Dublin). Mensen kunnen besmet raken door direct of indirect contact met besmette dieren of dierlijke feces (feco-oraal). De meeste besmettingen worden opgelopen door consumptie van besmette dierlijke producten (bijvoorbeeld vlees of eieren), maar milieuroutes (water) spelen waarschijnlijk ook een rol.
Methode
Incidentele gevallen van salmonellose bij de mens zijn in Nederland, in tegenstelling tot diverse andere Europese landen, niet meldingsplichtig. Salmonellose is alleen meldingsplichtig indien het een cluster van 2 of meer gerelateerde patiënten betreft, met een oorsprong in consumptie van besmet voedsel of drinkwater.
Inzicht in de trend van salmonellose wordt verkregen via kiemsurveillance die door het het Rijksinstituut voor Volksgezondheid en Milieu (RIVM) wordt uitgevoerd. Hierbij worden medische laboratoria gevraagd om isolaten naar het RIVM op te sturen voor typering (op kosten van het RIVM). De geschatte dekkingsgraad van deze surveillance op basis van de deelnemende streeklaboratoria, is 64% van de Nederlandse bevolking (voor laboratoriumbevestigde salmonellose). Deze dekking is representatief voor de gehele bevolking en biedt voldoende dekking voor het detecteren van landelijke uitbraken. De isolaten worden geserotypeerd waarna alle Enteritidis- (sinds begin 2019) en Typhimurium- (sinds begin 2020 en inclusief de monofasische variant) isolaten verder worden getypeerd met WGS. Deze typeringsmethode vervangt de Multi Locus Variable-number tandem repeat Analysis (MLVA) typering voor deze serovars vanwege het hogere onderscheidend vermogen van de WGS. Bij verheffingen van andere serovars wordt WGS toegepast om de uitbraak te verifiëren of bij brononderzoek een link te leggen met eventuele niet-humane isolaten.
Trends van Salmonella-infecties bij de mens worden het best beschreven in relatie tot hun bronnen. Als Nationaal Referentie Centrum voor Salmonella ontvangt het RIVM ook isolaten voor typering afkomstig van landbouwhuisdieren, huisdieren, milieu en voedsel. In opdracht van de Nederlandse Voedsel- en Warenautoriteit (NVWA) worden isolaten uit voedingsmiddelen grotendeels door Wageningen Food Safety Research (WFSR) verkregen en getypeerd. De isolaten komen uit een diversiteit aan monitoringsprogramma’s op boerderijen, slachthuizen en detailhandel. Deze zijn vaak onderdeel van het werk van de Gezondheidsdienst voor Dieren (GD), NVWA, Wageningen Food Safety Research (WFSR) en het RIVM. Als laatste worden isolaten ook, voor typering, ingestuurd door de faculteit Diergeneeskunde, dierentuinen, voedselindustrie en diervoederindustrie.
Resultaten
Trends in salmonellose bij de mens
In 2019 was het aantal ingestuurde Salmonella-isolaten (n=1002) van patiënten in Nederland iets hoger dan in 2017 (n=977) en 2018 (n=952) (tabel 1). Het totaal aantal laboratoriumbevestigde infecties in Nederland is op basis van de dekkingsgraad van de kiemsurveillance geschat op 1566 in 2019 (incidentie van 9.1/100,000/jaar). Het aantal patiënten met salmonellose is, na een lange periode van geleidelijke afname, redelijk stabiel sinds 2013. Net als in voorgaande jaren zijn de serovars Enteritidis (35%), Typhimurium (12%) en monofasische Typhimurium (13%) in 2019 de meest voorkomende veroorzakers van salmonellose bij mensen (tabel 1). Andere serovars maken allen afzonderlijk minder dan 3% van het totaal uit.
Tabel 1. De ontwikkeling van de belangrijkste Salmonella-serotypes in de mens. Serotypes waar significante verheffingen voor zijn gevonden zijn grijs gearceerd. Serotypes die minder dan 10 keer per jaar voorkomen, niet meldingsplichtig zijn (Typhi, Paratyphi A en B), en/of niet geassocieerd zijn met vlusters/uitbraken vallen onder categorie 'overig' (Bron: Laboratoriumsurveillance RIVM)
| Jaar | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | Reis 2019 |
| Totaal aantal | 1466 | 1298 | 2204 | 994 | 986 | 979 | 1160 | 977 | 952 | 1002 | 18% |
| Enteritidis | 516 | 380 | 421 | 256 | 213 | 239 | 319 | 246 | 250 | 354 | 19% |
| Typhimurium | 438 | 331 | 276 | 185 | 166 | 196 | 208 | 163 | 176 | 121 | 8% |
| SI 1,4,5,12:i:2- | 138 | 262 | 321 | 158 | 207 | 156 | 197 | 173 | 143 | 129 | 9% |
| Typhi | 10 | 7 | 7 | 10 | 12 | 9 | 7 | 9 | 10 | 13 | 46% |
| Paratyphi A | 5 | 4 | 6 | 8 | 7 | -- | 7 | 3 | 5 | 3 | 67% |
| Paratyphi B | 4 | 4 | 2 | 2 | 1 | 3 | 2 | 2 | 2 | 6 | 33% |
| Agona | 5 | 5 | 8 | 5 | 6 | 9 | 13 | 7 | 6 | 11 | 45% |
| Bovismorbificans | 4 | 6 | 14 | 6 | 6 | 5 | 34 | 19 | 5 | 11 | 9% |
| Brandenburg | 6 | 4 | 11 | 15 | 20 | 7 | 9 | 6 | 15 | 8 | 0% |
| Chester | 1 | -- | 2 | 3 | 12 | 11 | 12 | 10 | 16 | 20 | 20% |
| Derby | 9 | 10 | 10 | 11 | 15 | 12 | 16 | 7 | 18 | 7 | 0% |
| Dublin | 5 | 8 | 4 | 6 | 22 | 15 | 20 | 6 | 16 | 13 | 0% |
| Goldcoast | 2 | 6 | 9 | 5 | 2 | 10 | 8 | 6 | 22 | 8 | 0% |
| Heidelberg | 3 | 8 | 3 | 4 | 31 | 4 | 3 | 1 | 2 | 1 | 0% |
| Infantis | 18 | 13 | 22 | 30 | 26 | 35 | 26 | 38 | 25 | 26 | 8% |
| Kentucky | 14 | 14 | 11 | 17 | 6 | 9 | 31 | 27 | 7 | 13 | 15% |
| London | 3 | 7 | 3 | 5 | 9 | 3 | 1 | 3 | 2 | 7 | 0% |
| Muenchen | 2 | 2 | 4 | 6 | 2 | 8 | 1 | 5 | 5 | 10 | 0% |
| Newport | 21 | 29 | 20 | 12 | 12 | 9 | 11 | 18 | 21 | 16 | 56% |
| Paratyphi B var. Java | 9 | 15 | 6 | 10 | 7 | 13 | 26 | 17 | 15 | 19 | 32% |
| Saintpaul | 19 | 5 | 3 | 2 | 12 | 10 | 7 | 8 | 16 | 15 | 27% |
| Stanley | 6 | 7 | 16 | 12 | 7 | 16 | 9 | 11 | 12 | 16 | 31% |
| Thompson | 7 | -- | 803 | 25 | 7 | 5 | 7 | 4 | 2 | 2 | 50% |
| Virchow | 10 | 1 | 9 | 10 | 9 | 5 | 8 | 8 | 10 | 18 | 11% |
| OVERIGE | 211 | 170 | 213 | 191 | 169 | 190 | 178 | 180 | 151 | 155 | 12% |
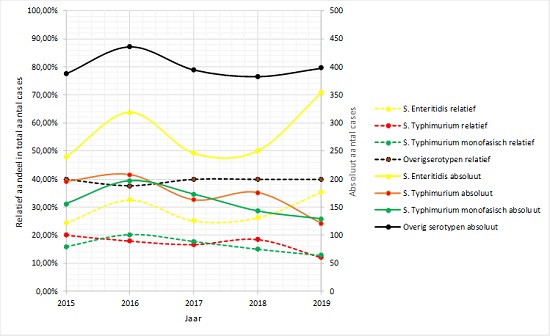
In 2019 was het aandeel (absoluut en relatief) S. Typhimurium en monofasische S. Typhimurium aanzienlijk lager (-22%) dan in voorgaande jaren, wat past in de langjarige dalende trend (figuur 1). Opvallend was echter het hoge aandeel S. Enteritidis, met zelfs meer patiënten dan in 2016/2017. Toen veroorzaakte S. Enteritids in eieren uit Polen een uitbraak in Nederland met meer dan 200 patiënten (2) (figuur 1). Er is op dit moment geen duidelijke verklaring voor deze stijging, maar kan in elk geval niet toegeschreven worden aan grote uitbraken.
Figuur 1. Trend in absolute aantallen cases (rechter as) en relatief aandeel ten opzichte van het totale aantal gerapporteerde Salmonella-gevallen (linker as) van 2015 tot en met 2019 voor S. Enteritidis, S. Typhimurium en monofasische S. Typhimurium (bron: RIVM laboratoriumsurveillance)
Het aandeel S. Infantis-infecties dat opgelopen werd in het buitenland daalde van 22% in 2018 naar 8% in 2019, terwijl het absoluut aantal patiënten gelijk bleef. Naar verhouding worden dus meer S. Infantis-infecties binnen Nederland opgelopen. Voor de overige serovars waren geen opvallende verschuivingen in reisgerelateerde infecties te zien.
In totaal waren er 6 landelijke significante verheffingen (3x S. Enteritidis, 1x S. Typhimurium, 1x S. Muenchen, en 1x S. Virchow) met in totaal 82 patiënten (8% van het totale aantal salmonellosepatiënten). In 2018 betrof dit 122 cases en 13% van het totaal. De gemiddelde omvang van de verheffing was hoger (11,7 personen) dan voorgaande jaren (respectievelijk 7,8 en 6,5 in 2017 en 2018).
Het aantal patiënten bij uitbraken is meestal het topje van de ijsberg; het werkelijke aantal van ligt naar schatting 15-20 maal zo hoog. Het overschakelen in 2019 naar WGS als routine typeringsmethode voor S. Enteritidis laat zien dat het merendeel (74.1%) van patiënten deel uit maakte van clusters van tenminste 2 patiënten en er dus relatief weinig sporadische gevallen waren.
Uit een recent uitgevoerde landelijke studie blijkt dat vanaf 2012 er een significante stijging is in het aandeel invasieve infecties ten opzichte van het totaal aantal Salmonella-infecties (3,5% in 2012 naar 5,5% in 2018) (3). Een verhoogd risico op invasieve infecties is geassocieerd met het winterseizoen, mannelijk geslacht, oudere leeftijd en wonen in landelijk gebied. Alhoewel in absolute zin S. Enteritidis en S. Typhimurium verantwoordelijk waren voor de meeste invasieve infecties, laten S. Dublin, S. Panama en S. Poona de hoogste proporties invasieve infecties zien. Echter alleen voor S. Enteritidis en S. Typhimurium (inclusief de monofasische variant) is een stijgende trend te zien in het absolute aantal en proportie invasieve infecties vanaf 2012. Mogelijk reflecteert dit onderliggende veranderingen in de biologie van Salmonella en/of gevoelige humane subpopulaties. Verwekkers van invasieve infecties bleken niet meer resistent te zijn tegen antibiotica te zijn dan verwekkers van niet-invasieve infecties.
Ziektelast van Salmonella bij de mens
Aan de hand van diverse epidemiologische onderzoeken in de afgelopen 20 jaar, kan op basis van het aantal patiënten met laboratoriumbevestigde salmonellose afkomstig uit de kiemsurveillance, geschat worden hoeveel mensen er totaal in de algemene bevolking acute gastro-enteritis krijgen door Salmonella. Hiermee kan ook de ziektelast in DALY’s (Disability Adjusted Life Years) en de cost-of-illness (COI) worden geschat. Voor 2019 wordt het totaal aantal patiënten met acute gastro-enteritis veroorzaakt door Salmonella geschat op 25.971 (incidentie 150/100,000/jr) en wordt de ziektelast geschat op 1.099 DALY’S. De COI geassocieerd met deze ziektelast komt in 2019 op € 19 miljoen. De populatie ziektelast van Salmonella in 2019 is daarmee vergelijkbaar met voorgaande jaren en is daarmee de op 4-na hoogste ziektelast onder de voedselpathogenen na Campylobacter (3303 DALYs), toxoplasma (1900 DALYs), en norovirus (1900 DALYs) (ter vergelijk: de ziekte met de hoogste ziektelast is influenza met meer dan 10,000 DALYs). Voor Salmonella-infecties wordt geschat dat naast reizen, milieu contact en mens-op-mens overdracht, ongeveer 55% van de infecties door besmet voedsel wordt veroorzaakt.
Salmonellose in landbouwhuisdieren
Het algemeen NVWA-monitoringsprogramma landbouwhuisdieren (inclusief controle slachthuizen) liet zien dat bij varkens S. Typhimurium (36%) en de monofasische variant van S. Typhimurium (33%) domineerden (tabel 2). Bij runderen werden S. Typhimurium (35%) en S. Dublin (29%) het meest geïsoleerd, gevolgd door de monofasische variant van S. Typhimurium (12%). Bij pluimvee (inclusief pluimveeproducten) waren de meest geïsoleerde serovars S. Infantis (38%), S. Paratyphi B var. Java (11%) en S. Enteritidis (10%). Onder leghennen was S. Enteritidis (58%) het meest frequent geïsoleerd, gevolgd door S. Typhimurium (9%).
Tabel 2. De ontwikkeling van de belangrijkste Salmonella-serotypes in landbouwhuisdieren 2018-2019 (Bron: Laboratoriumsurveillance RIVM en monitoring programma NVWA). Voor een lijst van de jaren 2012-2019 zie de bijlage
| Serotypes | 2018 | 2019 | ||||||
| V | R | S | L | V | R | S | L | |
| Totaal aantal | 91 | 61 | 107 | 50 | 133 | 105 | 166 | 45 |
| Typhimurium | 29 | 24 | 4 | 2 | 48 | 37 | 6 | 4 |
| SI 1,4,5,12:i:- | 25 | 10 | 1 | 44 | 13 | 1 | ||
| Enteritidis | 21 | 2 | 17 | 26 | ||||
| Infantis | 3 | 1 | 56 | 1 | 6 | 2 | 63 | 3 |
| Paratyphi B var. Java | 27 | 18 | 2 | |||||
| Heidelberg | 2 | 1 | ||||||
| Derby | 12 | 13 | 1 | |||||
| Dublin | 1 | 15 | 2 | 30 | ||||
| Brandenburg | 5 | 1 | 1 | 3 | 2 | |||
| Agona | 4 | 1 | 2 | |||||
| Livingstone | 1 | 2 | 1 | 2 | ||||
| Minnesota | ||||||||
| Kedougou | 1 | 19 | 17 | |||||
| Goldcoast | 3 | 2 | 3 | 1 | 3 | |||
| Mbandaka | 1 | 1 | ||||||
| Anatum | ||||||||
| Braenderup | 1 | 1 | ||||||
| Rissen | 3 | 1 | 1 | |||||
| Indiana | 1 | 9 | ||||||
| Newport | 1 | 1 | 4 | |||||
| Jerusalem | ||||||||
| Montevideo | ||||||||
| Overig | 9 | 10 | 1 | 3 | 9 | 16 | 26 | 8 |
In het kader van het gezamenlijke RIVM-NVWA-project Surveillance Landbouwhuisdieren werd in 2018 en 2019 onderzoek gedaan bij vleeskuikens. Hierbij is gebruik gemaakt van de uitslagen van de officiële Salmonella-status uit de reguliere pluimveemonitoring Nationaal Controle Programma Salmonella (NCPS), waarbij de Salmonella-gegevens uit de KIPnet-database werden gebruikt (4). In de onderzochte steekproef van 198 bedrijven werd bij 22 bedrijven (11,3%) Salmonella gemeld. De meest gevonden serovars waren S. Paratyphi B var Java (10x) en S. Infantis (9x). Daarnaast werden S. Agona, S. Goldcoast en S. Saintpaul elk gevonden op 1 bedrijf. Uit de risicofactoranalyse bleek het naleven van 2 hygiënemaatregelen (‘geen contact met ander pluimvee in de afgelopen 12u’ en ‘handen wassen voor het betreden van de stal’) gerelateerd aan een kleinere kans op aanwezigheid van Salmonella bij de vleeskuikens op het bedrijf. Daarentegen werd Salmonella vaker aangetoond op bedrijven met een hogere dagdosering van antibiotica bij de dieren.
De bestrijding van zoönotische Salmonella bij pluimvee is op Europees niveau gereguleerd in Verordening (EG) nr 2160/2003 en de daarop gebaseerde uitvoeringsverordeningen (EG) nr 200/2010 en (EG) nr 517/2011. Door het opheffen van de productschappen per 1 januari 2015 wordt de bestrijding sinds die datum uitgevoerd door de NVWA. Voor pluimvee geldt een monitoringsplicht. Wanneer een laboratorium in een monitoringsmonster of in een ander van pluimvee afkomstig monster 1 van de aangewezen Salmonella-serovars aantoont, moet dit worden gemeld bij de NVWA. In legkoppels zijn dit S. Enteritidis en S. Typhimurium en in vermeerderingskoppels daarnaast ook S. Infantis, S. Hadar, S. Virchow en voor ouderdieren van vleeskuikens ook S. Paratyphi B var Java. Deze meldingsplicht geldt op stalniveau.
- Wat betreft legkoppels zijn in 2019 45 verdachte stallen gemeld op 27 leghenbedrijven. Van de 45 verdachte stallen werd voor 26 stallen verificatieonderzoek aangevraagd, waarbij in 18 stallen de besmetting werd bevestigd en in de overige 8 gevallen was het verificatieonderzoek negatief. Voor 19 stallen werd de besmetting door de houder geaccepteerd. Naast de verdachte stallen zijn in 2019 ook 47 aanpalende stallen onderzocht door de NVWA. Hierbij werden 14 stallen positief verklaard, 13 keer S. Enteritidis, 1 keer S. Typhimurium en 1 keer zonder onderzoek omdat de dieren voor het onderzoek al met een positieve status werden geslacht.
- Hiernaast waren er in 2019 nog 3 meldingen van opfoklegkoppels, bij 2 koppels is nader onderzoek uitgevoerd, deze bleken negatief, en 1 koppel was al door de eigenaar geëuthanaseerd.
- Wat betreft vermeerderingskoppels zijn in 2019 17 stallen van 7 bedrijven aan de NVWA gemeld waarbij in 8 stallen Salmonella-serovars werden aangetoond bij het verificatieonderzoek door de NVWA (1 keer S. Infantis, 1 keer S. Typhimurium en 6 keer S. Enteritidis). Bij 1 stal werd het koppel door de eigenaar geëuthanaseerd voordat NVWA onderzoek kon doen, en deze stal werd als positief voor S. Infantis verklaard. In 2019 werden ook 2 stallen van 2 opfokvermeerderingsbedrijven gemeld. Bij het verificatieonderzoek door de NVWA bleek 1 stal besmet, waarbij eenmaal S. Java werd aangetoond, bij 1 stal waren de kippen al door de eigenaar geëuthanaseerd (vooruitlopend op NVWA-actie).
- Tot slot zijn in 2019 in 32 vleeskuikenstallen Salmonella-besmettingen aangetoond op 25 vleeskuikenbedrijven.
Salmonella in levensmiddelen
WFSR onderzoekt in opdracht van de NVWA jaarlijks een groot aantal vleesmonsters, vleesproducten en andere levensmiddelen. Voor Salmonella zijn afwezigheidsnormen opgenomen in bijvoorbeeld de Europese verordening 2073/2005, en de Warenwetbesluit Bereiding en behandeling van levensmiddelen. Zo mogen, volgens EU/2073/2005, in vers pluimveevlees de 2 bij mensen meest voorkomende serovars S. Enteritidis en S. Typhimurium, niet voorkomen. In pluimveevleesbereidingen, zoals gekruid pluimveevlees en gehakt, mag geen enkel type Salmonella voorkomen. In ~2-3% van de monsters van vers vlees en vleesbereidingen van kip is in 2019 Salmonella gevonden (tabel 3), dit percentage is sinds enkele jaren stabiel.
Voor andere typen vers vlees dan kippenvlees (rund, varkens, lam etc.) gelden geen normen voor Salmonella. De NVWA volgt wel de aanwezigheid van onder andere Salmonella in deze typen producten. In gehakt vlees, vleesbereidingen en vleesproducten mag géén Salmonella zitten. Betreffende vers varkensvlees, vers lamsvlees vers rund/kalfvlees was de prevalentie in 2019 laag (<1%). Exotisch vlees is vaker besmet met Salmonella (tabel 3).
Figuur 2. Geschatte bijdrage aan de humane, laboratoriumbevestigde salmonellose (linker y-as) door reizen (of onbekend), landbouwhuisdieren of hun producten. Omvangrijke explosies die niet representatief zijn voor de Salmonella-status van de Nederlandse vee- en pluimveestapel, zijn in donkerpaars aangegeven (Bron: Laboratoriumsurveillance RIVM)
In producten die zonder verhitting kunnen worden geconsumeerd mag geen Salmonella aanwezig zijn. Over het algemeen is de prevalentie van Salmonella op deze producten afwezig tot zeer laag, behalve voor vers en gedroogde kruiden waar de prevalentie 3-4% bedraagt (tabel 3).
Tabel 3. Salmonella in levensmiddelen in 2019
| Product | N | %+ | Salmonella (sero)type | ||
| Kippenvlees | Kip vers vlees | 237 | 3 | 5x S. Infantis 1x S. Paratyphi B Java 1x S. Typhimurium | |
| Kipbereiding (bijvoorbeeld gekruid of gehakt | 294 | 2 | 3x5x S. Infantis 1x S. Paratyphi B Java 1x S. Virchow 1x S. Indiana | ||
| Vers vlees anders dan kip | Rundvlees | 286 | 0 | ||
| Kalfsvlees | 211 | 1,0 | 2x S. Dublin 1x S. Typhimirium 1x S. Infantis | ||
| Varkensvlees | 297 | 1x S. Typhimutium | |||
| Lamsvlees | 240 | 1x S.enteria subsp. diarizonae | |||
| Vleesbereidingen anders dan kip | Gehakt en gekruid vlees | 302 | 1 | ||
| rundersaucijs | 1x S. Dublin | ||||
| Soepvlees | 1x S. Newport | ||||
| Chipolataworst | 1x S. Typhimurium monophasic | ||||
| Exotisch vlees (kangoeroe, struisvogel, krokodil, kikker) | 49 | 6,1 | 1x S. Bovismorbificans (kikker) 1x S. non-enterica ssp. (krokodil) | ||
| Direct te consumeren vleesbereiding | |||||
| Filet américain | 139 | 0,7 | 1x S. Dublin | ||
| Osseworst | 75 | 0 | |||
| Vis, garnalen, schaal/schelpdieren | Ingevroren, geïmporterde producten, aquacultuur | ||||
| Garnalen | 101 | 1,9 | 1x S. Aberdeen 1x S. Weltevreden | ||
| Tilapia | 103 | 0 | |||
| Pangasius | 99 | 0 | |||
| Verse mosselen | 116 | 0,9 | 1x S. Braenderup | ||
| Verse oesters | 98 | 1 | 1x S. Aberdeen | ||
| Gekookteschaal/schelpdieren | 45 | 0 | |||
| Overige (naar verwachting rauw te consumeren) | Superfoods (bijvoorbeeld lijnzaad, chiazaad, moerbeibes, hennepzaad | 299 | |||
| Melk van melktaps (99 koe, 5 geit) | 104 | 0 | |||
| Zeewier | 51 | 0 | |||
| Verse groenten | 819 | 0,1 | non-enterica species of mogelijk S. Sipane | ||
| Wokgroenten | 264 | 0 | |||
| Maaltijdsalades | 280 | 0 | |||
| Paddestoelen | 75 | 0 | |||
| Verse kruiden | 52 | 3,9 | monofasische S. Typhimurium (basilicum) | ||
| Gedroogde kruiden | 63 | 3,2 | S. Bareilly, S. Newport (kurkuma), S. Caracas (zwarte peper) | ||
Bronnen van besmetting
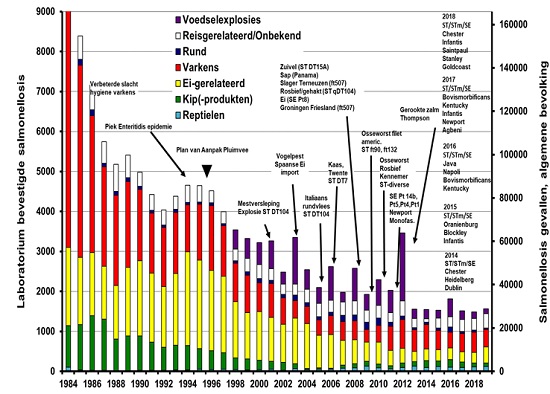
De geschatte bijdragen aan het voorkomen van salmonellose bij mensen door reizen, landbouwhuisdieren en hun producten, worden getoond in figuur 2. Het bronattributiemodel schat de verdeling van het voorkomen van de verschillende van serovars bij de mens op basis van de verdeling van het voorkomen in de verschillende bronnen. Daarbij betrekt men ook het geconsumeerde volume, de besmettingsgraad en de fractie van het voedsel wat rauw of goed doorbakken wordt geconsumeerd (5). In tegenstelling tot de historisch laagste schatting van aan ei gerelateerde infecties in 2018 (18%) ten opzichte van de afgelopen 35 jaar, zien we in 2019 een stijging van het aantal aan ei gerelateerde infecties tot 26%. Dit kwam vooral door het relatief hogere aantal gemelde S. Enteritidis-infecties in 2019. Het aandeel van varkens als bron is nog steeds het hoogst en was in 2019 28%. Dit is lager dan die in 2018 (34%) en werd voornamelijk veroorzaakt door het lagere aantal gemelde S. Typhimurium-infecties. Slechts 2% was afkomstig van rund en 6% van kip. Ongeveer 7% van de Salmonella-infecties werd veroorzaakt door contact met reptielen (Salmonella is een commensale darmbacterie bij reptielen). Van ~19% kon de bron niet worden geschat of was de Salmonella-infectie in het buitenland opgelopen.
Resistentieontwikkeling
Antibioticabehandeling wordt alleen geadviseerd voor patiënten met een verhoogd risico op complicaties en bij invasieve infecties (sepsis, bacteriemie). Ciprofloxacine is daarbij het eerst middel van keuze. De MARAN-rapportage over 2019 beschrijft de resistentie van Salmonella-stammen bij mens, landbouwhuisdieren, diervoer en voedsel (6). Over het algemeen zijn de resistentieniveaus onder Salmonella gelijk gebleven ten opzichte van 2018. Van alle geteste stammen uit patiënten was 17% resistent tegen ciprofloxacine (wat de primaire keuze is voor eventuele behandeling). De hoogste niveaus van resistentie tegen ciprofloxacine werden waargenomen onder S. Chester, S. Kentucky, S. Paratyphi B var. Java, S. Infantis, en S. Enteritidis. De resistentie tegen ciprofloxacine onder isolaten afkomstig van kippenvlees is gedaald, maar nog steeds erg hoog (69% in 2018, 58% in 2019).De fractie isolaten (alle bronnen) met resistentie tegen derdegeneratie-cefalosporines is voor het eerst sinds 2012 afgenomen. Carbapenemresistentie is tot dusverre nog niet in de Nederlandse monitoring en surveillance voor Salmonella waargenomen, ook niet in 2019. Het plasmide- overdraagbare colistineresistentiegen mcr werd ook in 2019 niet gevonden. Isolaten die verdacht werden van ESBL-productie werden in 2019 24 keer (1.3%, waarvan 1% moleculair bevestigd) aangetroffen in 19 patiëntisolaten, in 2 diervoederisolaten, in 1 pluimvee-isolaat, 1 varkensisolaat en in 1 isolaat van onbekende oorsprong. In totaal ging het om 9 verschillende serovars waarvan S. Infantis, S. Typhimurium (inclusief de monofasische variant) en S. Kentucky het meest voorkwamen. In kippenvlees werden geen ESBL-verdachte isolaten aangetroffen.
In samenwerking met het European Centre for Disease prevention and Control (ECDC) is een specifiek onderzoek uitgevoerd naar de verspreiding van ciprofloxacineresistente ESBL (blaCTX-M-14b) -producerende S. Kentucky in Europa (7). Op basis van evolutionair onderzoek is aangetoond dat deze stammen meerdere keren vanuit Noord-Afrika in Europa zijn geïntroduceerd en nu een stabiele populatie hebben gevormd. Een factor die mogelijk bijdraagt aan de succesvolle verspreiding van deze kloon is het feit dat het blaCTX-M-14b op het chromosoom ligt (en dus niet op een plasmide) en niet gemakkelijk verloren gaat. Opvallend is dat ESBL-producerende S. Kentucky tot op heden niet is aangetroffen in het Nederlandse dierreservoir.
Voor een aanvullend onderzoek naar multiresistentie bij S. Infantis zijn 14 S. Infantis-isolaten uit de vleeskuikenbedrijven aangesloten bij het project Surveillance Landbouwhuisdieren, 13 multiresistente S. Infantis-isolaten uit patiënten en enkele isolaten uit varkens en kippenvlees gesequenced; 32 isolaten in totaal. Uit de fylogenetische analyse op basis van core genome multilocus sequence typing (MLST) ontstond het beeld van een heterogene S. Infantis-populatie met enkele kleine clusters. In het merendeel van de onderzochte isolaten (90%), zowel van vleeskuikens als van patiënten, werd het megaplasmide pESI gevonden. Dit plasmide is de laatste jaren sterk verspreid in S. Infantis-isolaten wereldwijd en bevat antibioticaresistentiegenen en virulentiegenen (8). In de onderzochte isolaten werden 2 typen pESI gevonden, waarbij 1 type alleen bij 5 patiëntisolaten werd aangetroffen. In silico screening van de sequenties liet een hoge prevalentie (70-95%) zien van resistentiegenen tegen aminoglycosiden, sulfanomiden, tetracycline en trimethoprim. Daarnaast werd ook resistentie tegen (fluoro)quinolonen, op basis van mutaties in het chromosomale gen gyrA, vaak gevonden. In 5 patiëntisolaten met een alternatief pESI-type werd daarnaast het ESBL-gen blaCTX-M-65 gevonden. Dit onderzoek laat zien dat multiresistente S. Infantis-isolaten zich ook in Nederland hebben verspreid in vleeskuikens en eveneens voorkomen bij patiënten.
Auteurs
E. Franz (1), B. Wit (2), B. Wullings (3), K. Veldman (4), R. Pijnacker (1), M. van den Beld (1), M. Opsteegh (1), A. van Hoek (1), J. van der Giessen (1), T. Bosch (1), L. Mughini-Gras (1)
- Centrum Infectieziektebestrijding, Rijksinstituut voor Volksgezondheid en Milieu, Bilthoven
- Nederlandse Voedsel- en Warenautoriteit (NVWA), Utrecht
- Wageningen Food Safety Research, Wageningen University & Research, Wageningen
- Wageningen Bioveterinary Research, Wageningen University & Research, Lelystad
Correspondentie
Literatuur
- Lapo Mughini-Gras, Wilfrid van Pelt. 2014. Salmonella source attribution based on microbial subtyping: does including data on food consumption matter? Int J Food Microbiol. 191:109-115. doi: 10.1016/j.ijfoodmicro.2014.09.010
- Roan Pijnacker; Timothy Dallman, PhD; Aloys Tijsma, PhD; Gillian Hawkins, MBChB; Lesley Larkin, PhD; Saara Kotila, MSc; Giusi Amore, PhD; Ettore Amato, PhD; Pamina-Mika Suzuki, MSc; Sofieke Klamer,MSc; Sarah Denayar, PhD; Judit Pászti; Gareth Hughes, PhD; Jacquelyn McCormick, MPH; Hassan Hartman, PhD; Lin Brandal, PhD; Derek Brown, MSc;Joël Mossong, PhD; cecilia Jernberg, PhD; Luise Muller, MSc; Daniel Palm, PhD; Ettore Severi, MSc; Joanna Golebiowska, DVM; Blaženka Hunjak, PhD; Slawomir Owczarek, MSc; Simon Le Hello, PhD; Patricia Garvey, PhD; Kirsten Mooijman, MSc; Ingrid Friesema, PhD; Coen Van der Weijden, BSc;Menno Van der Voort, PhD; Valentina Rizzi, PhD; Eelco Franz, PhD. 2019. A prolonged multi-country outbreak of Salmonella Enteritidis linked to eggs from Poland: a collaborative microbiological and epidemiological study. The Lancet Infectious Diseases 2019 Jul;19(7):778-786. doi: 10.1016/S1473-3099(19)30047-7. Epub 2019 May 24.
- Mughini-Gras, L., Pijnacker, R., Duijster, J., Heck, M., Wit, B., Veldman, K., Franz, E. 2020. Changing epidemiology of invasive non-typhoid Salmonella infection: a nationwide population-based registry study/ Clinical Microbiology and Infection 26(7), pp. 941.e9-941.e14.
- Cuperus et al., 2020. Surveillance van zoonosenverwekkers in de vleeskuikenhouderij. Tijdschrift voor diergeneeskunde 145 (11)p37-39. https://rivm.openrepository.com/handle/10029/624351
- Lapo Mughini-Gras, Remko Enserink, Ingrid Friesema, Max Heck, Yvonne van Duynhoven, Wilfrid van Pelt. 2014. Risk factors for human salmonellosis originating from pigs, cattle, broiler chickens and egg laying hens: a combined case-control and source attribution analysis. PLoS One, Feb 4;9(2):e87933. doi: 10.1371/journal.pone.0087933.
- MARAN 2020. Monitoring of Antimicrobial Resistance and Antibiotic Usage in Animals in the Netherlands in 2019. https://www.rivm.nl/bibliotheek/rapporten/2020-0065.pdf.
- Claudia E Coipan , Therese Westrell, Angela H A M van Hoek , Erik Alm, Saara Kotila, Bas Berbers, Sigrid C J De Keersmaecker , Pieter-Jan Ceyssens, Maria Louise Borg, Marie Chattaway , Jacquelyn McCormick, Timothy J Dallman, Eelco Franz. 2020. Genomic epidemiology of emerging ESBL-producing Salmonella Kentucky bla CTX-M-14b in Europe. Emerg Microbes Infect Sep 8;1-252. doi: 10.1080/22221751.2020.1821582.
- Alba, P., et al. 2020. Molecular epidemiology of Salmonella Infantis in Europe: insights into the success of the bacterial host and its parasitic pESI-like megaplasmid. . Microb. Genom., 6(5): e000365.
Infectieziekten Bulletin, jaargang 31, nummer 3, december 2020